Transcétolase
La transcétolase est une transférase qui catalyse la réaction :
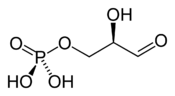
- sédoheptulose-7-phosphate + D-glycéraldéhyde-3-phosphate D-ribose-5-phosphate + D-xylulose-5-phosphate.
| Transcétolase | ||
 Transcétolase humaine, avec TPP en jaune et xylulose-5-phosphate en noir (PDB 4KXV[1]). | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | TKT | |
| N° EC | 2.2.1.1 | |
| Homo sapiens | ||
| Locus | 3p21.1 | |
| Masse moléculaire | 67 878 Da[2] | |
| Nombre de résidus | 623 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Cette enzyme intervient dans la voie des pentoses phosphates et la phase de régénération du ribulose dans le cycle de Calvin, participant à la photosynthèse chez les plantes.
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | TPP |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Transcétolase et cancers
Comme les cellules cancéreuses subissent une augmentation du stress oxydatif, elles combattent ce stress par la voie du pentose phosphate (PPP) qui génère des antioxydants (NADPH)[3]. Or la transcétolase (TKT) (en tant qu'enzyme participant au processus du PPP) est nécessaire à ce phénomène[3] ; elle participe donc à la croissance du cancer dans lequel elle limite le stress oxydatif. Elle a donc a été proposée comme cible adjointe de projets de nouveaux traitements anticancéreux ; il s'agira alors de rendre les cellules cancéreuses plus vulnérables à un traitement ciblé existant (ex sorafénib) en diminuant leur capacité de résistance au stress oxydatif[3].
Biochimie
Cette enzyme catalyse en sens opposé deux réactions réversibles dans ces deux voies métaboliques :
- Dans la première réaction catalysée par la transcétolase dans la voie des pentoses phosphates, la thiamine pyrophosphate accepte un fragment à deux atomes de carbone du D-xylulose-5-phosphate, un cétose à cinq atomes de carbone, et transfère ce fragment au D-ribose-5-phosphate, un aldose à cinq atomes de carbone, pour former du sédoheptulose-7-phosphate, un cétose à sept atomes de carbone, ainsi que du glycéraldéhyde-3-phosphate, un aldose à trois atomes de carbone ; dans le cycle de Calvin, la transcétolase catalyse la réaction inverse, c'est-à-dire la conversion du sédoheptulose-7-phosphate et du glycéraldéhyde-3-phosphate en ribose-5-phosphate et xylulose-5-phosphate, ce qui constitue la seconde intervention de cette enzyme dans cette voie métabolique.
 Illustration du schéma réactionnel catalysé par la transcétolase.
Illustration du schéma réactionnel catalysé par la transcétolase.
- La seconde réaction catalysée par cette enzyme dans la voie des pentoses phosphates consiste à transférer un fragment à deux atomes de carbone du xylulose-5-phosphate vers l'érythrose-4-phosphate pour former du fructose-6-phosphate et du glycéraldéhyde-3-phosphate ; dans le cycle de Calvin, la transcétolase catalyse là encore la réaction inverse, qui est la première intervention de cette enzyme dans cette voie métabolique.
Chez les mammifères
Chez les mammifères la transcétolase relie la voie des penstoses phosphates à la glycolyse, permettant de métaboliser l'excès de sucres par la principale voie de dégradation des glucides.
Elle est indispensable à la production de NADPH + H+, particulièrement dans les tissus ayant une forte activité biosynthétique, comme la lipogenèse par le foie et les glandes mammaires ou encore la synthèse des stéroïdes dans le foie les glandes surrénales.
La thiamine pyrophosphate et l'ion Ca2+ sont des cofacteurs essentiels.
Références
- (en) Stefan Lüdtke, Piotr Neumann, Karl M. Erixon, Finian Leeper, Ronald Kluger, Ralf Ficner et Kai Tittmann, « Sub-ångström-resolution crystallography reveals physical distortions that enhance reactivity of a covalent enzymatic intermediate », Nature Chemistry, vol. 5, no 9, , p. 762-767 (PMID 23965678, DOI 10.1038/nchem.1728, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Iris Ming-Jing Xu & al. (2016) Transketolase counteracts oxidative stress to drive cancer development ; PNAS, mis en ligne avant impression le 25 janvier 2016, doi: 10.1073/pnas.1508779113
Annexes
Bibliographie
- Iris Ming-Jing Xu & al. (2016) Transketolase counteracts oxidative stress to drive cancer development ; PNAS, mis en ligne avant impression le , doi: 10.1073/pnas.1508779113
- Portail de la biochimie