Tétrakis(3,5-bis(trifluorométhyl)phényl)borate
Le tétrakis[3,5-bis(trifluorométhyl)phényl]borate, couramment noté [BArF4]–, est un anion non coordinant de formule [{3,5-(CF3)2C6H3}4B]–. Il est parfois appelé anion de Kobayashi en référence à Hiroshi Kobayashi, qui dirigeait l'équipe à l'origine de la première synthèse de cet anion[1], et est couramment surnommé « BARF » en raison de sa notation abrégée[2]. Il est constitué de quatre groupes aryle fluorés disposés selon une géométrie tétraédrique autour d'un atome de bore. Chacun de ces groupes aryle est aromatique et plan.
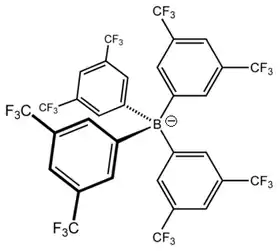
Le [BArF4]– a été conçu dans le cadre de recherches sur des anions qui se coordonnent plus faiblement que les ions PF6–, BF4– et ClO4– alors disponibles[3]. Les sels de cet anion sont des solides disponibles en solutions aqueuses ou non aqueuses. Le BARF peut former des catalyseurs dans lesquels le site actif requiert un anion qui ne formera pas de complexe avec le métal et n'interférera pas avec le cycle catalytique, comme pour la préparation de polycétones[4].
Tétrakis[3,5-bis(trifluorométhyl)phényl]borate de sodium
Le sel de sodium de l'ion BARF est noté NaBArF4, ou parfois NaBArF24[2]. Il a été synthétisé pour la première fois par une équipe dirigée par Kobayashi, travaux publiés en 1984[1]. Un réactif de Grignard a été préparé en faisant réagir du 1-iodo-3,5-bis(trifluorométhyl)benzène avec du magnésium métallique dans l'éther diéthylique (CH3CH2)2O anhydre pour former de l'iodure de 3,5-bis(trifluorométhyl)phénylmagnésium [3,5-(CF3)2C6H3]MgI. Une solution de trifluorure de bore BF3 dans l'éther a ensuite été ajoutée à ce réactif de Grignard pour donner 84 % de sel de BARF après purification et chromatographie sur colonne[1].
Une voie de synthèse a par la suite été développée en mettant à profit une réaction d'échange magnésium-brome entre le 1-bromo-3,5-bis(trifluorométhyl)benzène et le chlorure d'isopropylmagnésium pour produire l'aryle de Grignard à faire réagir avec le tétrafluoroborate de sodium NaBF4 :
- NaBF4 + 4 ArFMgBr → NaBArF4 + 4 MgBrF.
Anions non coordinants
Les anions non coordinants sont des anions qui interagissent peu ou pas du tout avec les cations, ce qui est une propriété intéressante pour étudier les cations très électrophiles[5]. En chimie de coordination, ce terme peut être employé pour désigner des anions qui ne forment pas facilement des liaisons directes avec l'atome métallique d'un complexe. L'hexafluorophosphate PF6– est un anion non coordinant dans les deux sens du terme[6],[7]. Trois anions non coordinants sont largement utilisés : l'hexafluorophosphate PF6–, le tétrafluoroborate BF4– et le perchlorate ClO4– ; l'ion hexafluorophosphate est le moins coordinant des trois[8] et est utilisé par rapport à cette propriété. Le BARF a été introduit dans les années 1990 comme anion bien moins coordinant que l'anion hexafluorophosphate[3].
Le NaBArF4 peut être utilisé pour déprotéger les composés carbonyle protégés par des cétals ou des acétals[9],[10]. Par exemple, la déprotection du 2-phényl-1,3-dioxolane en benzaldéhyde peut être réalisé par l'eau en cinq minutes à 30 °C[11] :
- PhCH(OCH2)2 + H2O PhCHO + HOCH2CH2OH.
On connaît plusieurs composés du BARF. L'acide de Brookhart est ainsi le sel de l'anion BARF avec le cation oxonium d'éther diéthylique [(Et2O)2H]BArF4. On peut l'obtenir à partir du sel de sodium dans l'éther diéthylique en présence de chlorure d'hydrogène dans la mesure où le chlorure de sodium est insoluble dans l'éther diéthylique, ce qui facilite l'échange de cations[3] :
On connaît également des sels de BARF avec des cations hexa(acétonitrile)métal(II) [M(CH3CN)6]2+ où M représente un atome de vanadium, de chrome, de manganèse, de fer, de cobalt ou de nickel[12].
Notes et références
- (en) Nishida Hiroshi, Takada Naoko, Yoshimura Masaji, Sonoda Takaaki et Kobayashi Hiroshi, « Tetrakis[3,5-bis(trifluoromethyl)phenyl]borate. Highly Lipophilic Stable Anionic Agent for Solvent-extraction of Cations », Bulletin of the Chemical Society of Japan, vol. 57, no 9, , p. 2600-2604 (DOI 10.1246/bcsj.57.2600, lire en ligne)
- (en) Neal A. Yakelis et Robert G. Bergman, « Safe Preparation and Purification of Sodium Tetrakis[(3,5-trifluoromethyl)phenyl]borate (NaBArF24): Reliable and Sensitive Analysis of Water in Solutions of Fluorinated Tetraarylborates », Organometallics, vol. 24, no 14, , p. 3579-3581 (PMID 19079785, PMCID 2600718, DOI 10.1021/om0501428, lire en ligne)
- (en) M. Brookhart, B. Grant et A. F. Volpe Jr., « [(3,5-(CF3)2C6H3)4B]–[H(OEt2)2]+: a convenient reagent for generation and stabilization of cationic, highly electrophilic organometallic complexes », Organometallics, vol. 11, no 11, , p. 3920-3922 (DOI 10.1021/om00059a071, lire en ligne)
- (en) M. Brookhart, Francis C. Rix, J. M. DeSimone et James C. Barborak, « Palladium(II) catalysts for living alternating copolymerization of olefins and carbon monoxide », Journal of the American Chemical Society, vol. 114, no 14, , p. 5894-5895 (DOI 10.1021/ja00040a082, lire en ligne)
- (en) Ingo Krossing et Ines Raabe, « Noncoordinating Anions—Fact or Fiction? A Survey of Likely Candidates », Angewandte Chemie, International Edition, vol. 43, no 16, , p. 2066-2090 (PMID 15083452, DOI 10.1002/anie.200300620, lire en ligne)
- (en) J. A. Davies, Synthetic Coordination Chemistry: Principles and Practice, World Scientific, 1996, p. 165. (ISBN 9810220847)
- (en) S. Constant, J. Lacour, (2005). J.-P. Majoral éditeur, « New Trends in Hexacoordinated Phosphorus Chemistry », New Aspects in Phosphorus Chemistry, vol. 5, p. 3, Springer. (ISBN 354022498X)
- (en) H. Gordon Mayfield et William E. Bull, « Co-ordinating tendencies of the hexafluorophosphate ion », Journal of the Chemical Society A: Inorganic, Physical, Theoretical, , p. 2279-2281 (DOI 10.1039/J19710002279, lire en ligne)
- (en) Theodora W. Greene, Peter G. M. Wuts, « Dimethyl acetals », Greene's Protective Groups in Organic Synthesis, Wiley-Interscience, 3e édition, 1999, p. 297–304, 724–727. (ISBN 9780471160199).
- (en) Theodora W. Greene, Peter G. M. Wuts, « 1,3-Dioxanes, 1,3-Dioxolanes », Greene's Protective Groups in Organic Synthesis, Wiley-Interscience, 3e édition, 1999, p. 308–322, 724–727. (ISBN 9780471160199)
- (en) Chih-Ching Chang, Bei-Sih Liao, Shiuh-Tzung Liu, « Deprotection of Acetals and Ketals in a Colloidal Suspension Generated by Sodium Tetrakis(3,5-trifluoromethylphenyl)borate in Water », Synlett, vol. 2, , p. 0283-0287 (DOI 10.1055/s-2007-968009, lire en ligne)
- (en) W. E. Buschman et J. S. Miller,, « Synthesis of [MII(NCMe)6]2+ (M = V, Cr, Mn, Fe, Co, Ni) salts of tetra[3,5-bis(trifluoromethyl)phenyl]borate », Inorganic Syntheses, vol. 33, , p. 83-91 (DOI 10.1002/0471224502.ch2, lire en ligne)
- Portail de la chimie