Diaminobenzène
Le diaminobenzène, la phénylènediamine ou benzènediamine est un composé aromatique de formule C6H8N2, constitué d'un cycle benzénique substitué par deux groupes amine. Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
Cette page répertorie différents isomères, c’est-à-dire des molécules qui partagent la même formule brute.
Propriétés
| Diaminobenzène | |||
| Nom systématique | benzène-1,2-diamine | benzène-1,3-diamine | benzène-1,4-diamine |
| Autres noms | 1,2-diaminobenzène orthophénylènediamine o-phénylènediamine |
1,3-diaminobenzène métaphénylènediamine m-phénylènediamine |
1,4-diaminobenzène paraphénylènediamine p-phénylènediamine C.I. 76060 |
| Structure | 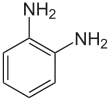 |
 |
|
| N° CAS | |||
| PubChem | 7243 | 7935 | 7814 |
| SMILES | C1=CC=C(C(=C1)N)N | C1=CC(=CC(=C1)N)N | C1=CC(=CC=C1N)N |
| Formule chimique | C6H8N2 | ||
| Masse moléculaire | 108,14 g mol−1 | ||
| État (CNTP) | solide | ||
| Apparence | cristaux incolores à rouge pâle[1] | cristaux incolores à jaunâtres odeur aminée[2] |
cristaux incolores à rouge pâle[3] |
| Point de fusion | 102,1 °C[1] | 63 °C[2] | 140 °C[3] |
| Point d'ébullition | 257 °C[1] | 284 °C[2] | 267 °C[3] |
| Masse volumique | 1,14 g·cm-3 (20 °C)[1] | 0,71 g·cm-3 (22 °C)[2] | 1,135 g·cm-3 (20 °C)[3] |
| Point d'éclair (coupelle fermée) |
156 °C[1] | 187 °C[2] | 156 °C[3] |
| Point d'auto-inflammation | 540 °C[1] | 560 °C[2] | 567 °C[3] |
| Limites d'explosivité | 1,5 vol.% ― [1] | 1,5 vol.% ― [3] | |
| Solubilité dans l'eau (20 °C) | 54 g·l-1[1] | 429 g·l-1[2] | 40 g·l-1[3] |
| pKA1[4] (de l'acide conjugué BH+) | 4,74 | 4,98 | 6,2 |
| pKA2[4] (de l'acide conjugué BH+) | 0,6 | 2,41 | 2,67 |
| LogP | 0,15 | -0,25 | -0,36 |
| SGH |    [1],[2], |   [3] | |
| Phrases H et P[1],[2],[3] | H312, H332, H341 et H351 H301, H317, H319 et H410 |
H301, H311, H331 et H341 H317, H319 et H410 |
H301, H311 et H331 H317, H319 et H410 |
| P273, P281 et P302+P352 P305+P351+P338 et P309+P310 |
P261, P273 et P280 P311 et P305+P351+P338 |
P273, P280, P302+P352 et P304+P340 P305+P351+P338 et P309+P310 | |
Les diaminobenzènes purs sont des solides cristallins quasi incolores. Les composés ortho et para peuvent aussi présenter une légère tente rouge pâle, et le composé méta une tinte jaunâtre. Ils s'oxydent rapidement dans l'air, et prennent alors une teint brune (dans le cas de l'o-phénylènediamine, il y a formation de l'o-quinonediimine, puis de la 2,3-diaminophénazine). De ce fait, on utilise plutôt leurs sels de dihydrochlorure qui sont plus stables.
Leurs points de fusion sont assez drastiquement différents. Le composé para qui a la plus grande symétrie, permettant plus de liaisons hydrogène, a aussi le point de fusion le plus élevé. Si le composé méta se dissout bien dans l'eau, ce n'est pas le cas des deux autres. Les trois composés sont en revanche très solubles dans les solvants organiques.
Production
Les diaminobenzènes sont préparés par réduction des nitroanilines correspondantes. On les réduit par le dihydrogène, dans le toluène (solvant), en présence d'un catalyseur, puis le produit est purifié par distillation. Il est également possible dans le cas du composé méta de partir du dinitrobenzène : la réduction du m-dinitrobenzène par Fe / HCl produit la m-phénylènediamine[5].
Utilisations
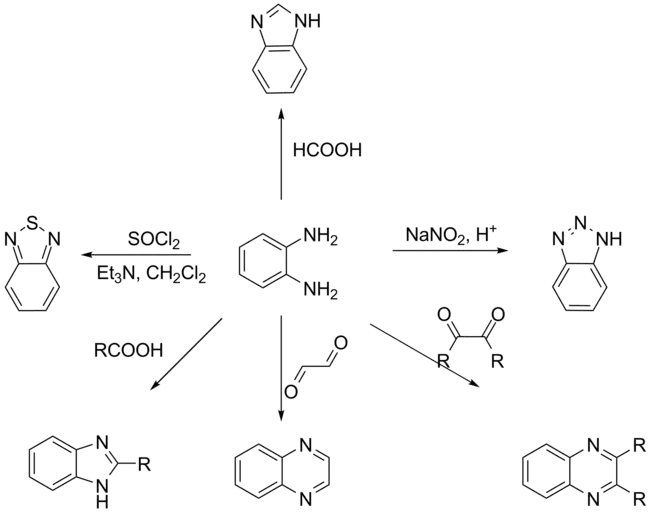
L'orthophénylènediamine est un composé de départ dans la synthèse de nombreux composées hétérocycliques, en particulier les benzotriazoles, les phénazines et les benzimidazoles. Ces derniers peuvent être produits par la condensation de la phénylènediamine avec un aldéhydes ou une cétones pour former une base de Schiff. Cette réaction permet ainsi la synthèse de benzimidazoles substitués.
Ces composé ont de multiples applications pratiques :
- les benzotriazoles sont utilisés dans la production de plastiques, de composés photochimiques, et de composé anticorrosion pour le cuivre.
- Benzimidazole, phénylendiamine-thiourée, quinoxaline sont à la base de nombreux pesticides,
- Ces composés servent aussi de base à la production de teintures et pigments. La phénylènediamine est également à la base de teinture pour cheveux. L'o-phénylènediamine et ses dérivé présents dans le cosmétiques sont sans doute responsables des syndromes allergiques chez les coiffeurs[6].
- Les dérivés de benzimidazole sont utilisés come absorbeur d'UV dans les cosmétiques, dans les polymères thermostables, et les composés pharmaceutiques (virucides et anthelminthiques à usage vétérinaire)
La quinoxalinedione peut être préparée par condensation de l'o-phénylènediamine avec l'oxalate de diméthyle. L'orthophénylènediamine permet également de synthétiser le 2-mercaptobenzimidazole, un antioxydant du caoutchouc. C'est enfin un substrat dans la méthode immuno-enzymatique ELISA.
L'industrie du plastique utilise de grandes quantités de p-phénylèndiamine, afin de produire des polyamides aromatiques. Avec l'acide téréphtalique, c'est le principal composant des aramides. Le paraphényl3ndiamine est également un intermédiaire dans la production de colorants azoïques et de nombreux composés pharmaceutiques. Comme le composé ortho, elle et ses dérivés sont utilisés en teintures cosmétiques, un usage découvert par Ernst Erdmann en 1888, et comme son isomère, elle pourrait être la cause
des réactions allergiques fréquente che les coiffeurs. La p-phénylèndiamine était enfin un composé actif de certains développeurs alcalins.
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Phenylendiamine » (voir la liste des auteurs).
- Entrée « o-Phenylenediamine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 septembre 2019 (JavaScript nécessaire).
- Entrée « m-Phenylenediamine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 septembre 2019 (JavaScript nécessaire).
- Entrée « p-Phenylenediamine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 septembre 2019 (JavaScript nécessaire).
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, (ISBN 0-8493-0303-6).
- (de) Hans Beyer, Wolfgang Walter, Lehrbuch der Organischen Chemie, Stuttgart, S. Hirzel Verlag, , 19e éd., 536, 542 p. (ISBN 3-7776-0356-2)
- Datenblatt bei Enius.
Voir aussi
- Aniline
- Triaminobenzène
- Tétraminobenzène
- Pentaminobenzène
- Hexaminobenzène
- Portail de la chimie