Nano-alliage métallique
Le terme nanoalliage est utilisé pour décrire des nanoparticules composées de plusieurs métaux ou d'un métal associé à d'autres éléments chimiques. En métallurgie, l'intérêt d'un alliage vient souvent de la combinaison des propriétés de ses constituants. De par sa taille nanométrique, un nanoalliage possède des propriétés différentes voire nouvelles par rapport à un alliage massif[1]. Comme pour les nanomatériaux, beaucoup de leurs propriétés sont liées à l'augmentation de la surface d'interaction avec le milieu extérieur. Dans le cas des nanoalliages, le potentiel de ces systèmes augmente encore en raison d'une très grande diversité structurale couplée aux effets d’ordre chimique et de ségrégation superficielle[2]. La taille des nanoparticules d'alliages varie de 1 à quelques centaines de nanomètres[3].
Histoire

Les nanoalliages sont utilisés depuis de nombreux siècles, en réalité depuis l’âge de bronze sans que les peuples y ayant recours en aient vraiment conscience. Ils étaient alors majoritairement utilisés pour leurs propriétés optiques, c'est-à-dire pour colorer certains objets. Dans les nanoalliages, à cette époque, on trouvait principalement des nanoparticules d'argent, d'or et de cuivre. En effet, ces nanoparticules sont responsables de la couleur d'un bon nombre de vitraux datant du Moyen Âge. À cette même époque, les nanoalliages étaient aussi utilisés pour donner un aspect métallique aux revêtements en céramiques[4].
Dans les plus anciennes utilisations pratiques des nanoalliages, beaucoup sont datées d'au moins l'époque romaine[3]. Les Romains, eux aussi, y avaient recours pour leurs propriétés optiques et pour colorer le verre. L'un des objets les plus connus et les plus anciens est la coupe de Lycurgue, qui contient des particules de nanoalliages d'argent et d'or[4]. Il date du IVe siècle apr. J.-C.
Avec le développement de la métallurgie depuis la révolution industrielle, de nouvelles combinaisons de métaux ont été développées pour répondre à une certaine demande de modernisation. C'est seulement au cours du 20e siècle que les nanoalliages ont réellement été étudié[5] et développé, en réponse à une forte émergence de l'usage des nanotechnologies[6].
Terminologies
Il existe des nano-alliages métalliques dits bimétalliques, c'est-à-dire composés seulement d'éléments appartenant à la famille des métaux de transition du tableau périodique, ou encore des nanoalliages composés d'un métal de transition et d'un autre élément appartenant à la famille principale des métaux[7]. Ceci peut être généralisé pour un nanoalliage avec plus de deux composants.
Les principaux nanoalliages étudiés dans la recherche présentant de plus grands intérêts sont concentrés sur les dernières colonnes des métaux de transition dans le tableau périodique, à savoir de 8 à 11, voire de 10 à 11 si l'on ne considère que les plus courants. On parle de nanoalliages de groupes 10, 11, 10-11[7].
Voici quelques exemples des principaux nano-alliages utilisés dans la vie de tous les jours :
- Au-Cu (or-cuivre), ou Cu-Ag, Au-Ag, ou même Cu-Au-Ag, qui sont de groupe 11 ;
- Ni-Pd, Pd-Pt ou nanoalliage nickel-platine Ni-Pt qui sont de groupe 10 ;
- des nanoalliages de groupes 10-11 tels que le Ni-Cu, le Cu-Pt ou le Ni-Au[7].
Structure
Morphologie
Tout comme les métaux massifs, les nanoparticules d’alliages, aussi appelées « clusters » peuvent cristalliser de manières différentes. Les structures et les formes obtenues sont intimement liées à la taille de la nanoparticule.
Jusqu’à une taille de quelques dizaines de nanomètres, les clusters de nanoparticules adoptent globalement les mêmes configurations cristallines que le métal massif (cubique centré, cubique à faces centrées, hexagonal compact).
En dessous de cette taille, l’effet du rapport du nombre d’atomes en surface sur le nombre d’atomes de cœur devient très important et le système tend à minimiser son énergie de surface en adoptant la morphologie la plus proche possible d’une sphère. Il existe alors une compétition entre l’ordre cristallin et la forme sphérique pour adopter la morphologie de moindre énergie.
Pour les nanoparticules à un seul élément chimique, la géométrie finale suivra la loi suivante[8] :
où sont les indices de Miller d'un plan atomique.
- est l'énergie de surface
- est la surface effective du plan considéré
- et la distance du plan par rapport au centre de la nanoparticule.
On voit alors que pour une valeur de fixée, si augmente alors la surface de ce plan doit diminuer pour satisfaire à la relation. Cette formule est aussi valable dans le cas de nano-alliages, néanmoins les valeurs de ne s'obtiennent qu'à partir de calculs complexes.
De cette relation résulte directement des géométries particulières, qui varient en fonction de la taille du cluster, appelées « polyèdres de Wulff ». Les facettes de ces polyèdres représentent des plans atomiques dont la compacité, donc les énergies de surface, diffèrent les uns des autres.

Il sera possible de voir apparaître des formes telles que l’octaèdre tronqué, pour les structures cubiques à faces centrées, de même que des formes présentant des ruptures avec la périodicité du réseau, et impossibles à trouver dans le métal massif telles que le décaèdre ou l’icosaèdre[9],[7].
Agencement atomique
Les nanoalliages peuvent être classifiés selon leur configuration atomique ou bien selon leur miscibilité.
Il existe quatre différents types de configuration des nanoalliages métalliques selon leur schéma de miscibilité[7],[9] :
- une carapace constituée d’un type d’atome qui entoure un noyau composé d’un autre type d'atome, aussi appelé cœur-coquille (figure 1). De même, il peut exister des nano-alliages dits « à couches », comportant un noyau composé d’un atome A, entouré par une carapace d’un atome B, qui sera elle-même encerclée par une autre couche de l’atome A ;
- des nanoparticules d'alliage caractérisées par une ségrégation complète ou quasi complète des atomes le composant : les deux parties peuvent partager la même surface (figure 2) ou encore être reliées seulement par quelques liaisons entre atomes. Ce type de configuration est appelé nanoparticule Janus en référence au dieu romain à deux têtes ;
- les nanoalliages dits « mélangés », lorsque la miscibilité est très bonne. Ils peuvent être désordonnés (figure 3a) ou ordonnés (figure 3b et 3c).
 Figure 1.
Figure 1. Figure 2.
Figure 2. Figure 3a.
Figure 3a. Figure 3b.
Figure 3b. Figure 3c.
Figure 3c.
Ces informations sont décrites pour un nanoalliage comportant deux types d'atomes, mais elles sont aussi valables pour des nanoalliages ternaires.
Propriétés et applications
Le changement des propriétés des nano-alliages par rapport à l'état massif vient principalement de l'augmentation de la fraction volumique des atomes de surface par rapport aux atomes de cœur. De la même manière, dans certains cas, la fraction volumique des joints de grain du matériau peut devenir plus importante que la fraction volumique des grains eux-mêmes[5], entraînant des modifications comportementales.
D'autres facteurs peuvent largement influencer les propriétés d'un nano-alliage tels que sa structure, sa taille ou sa composition chimique[10].
En catalyse
.png.webp)
La catalyse est aujourd’hui au cœur des enjeux du développement durable[11]. Ainsi elle est largement utilisée dans la plupart des procédés industriels (entre 80 % et 90 %)[8].
Ces dernières années, les nano-alliages métalliques ont été d’un grand intérêt pour la catalyse hétérogènee, grâce à leurs tailles de particule contrôlée, leur composition et leur structure, ainsi qu’une surface spécifique élevée et des sites de coordination de surface non saturés plus densément peuplés qui pourraient potentiellement améliorer les performances catalytiques par rapport aux catalyseurs classiques[12]. Ceci est notamment dû à la synergie des éléments de l'alliage. C'est en fait la combinaison entre l'ordre chimique et structurel de la particule atomique, et la chimie de surface de cette particule qui déterminera les propriétés catalytiques du nano-alliage[13]. Ces propriétés concernent principalement l'électrodialyse de la réaction de réduction de l'oxygène, ou la catalyse de l'oxydation du monoxyde de carbone dans sa phase gazeuse[13].
La perspective de l'utilisation de nano-alliages métalliques s'est très rapidement imposée comme une voie de recherche prometteuse, dont le principal intérêt est la réduction de la quantité de matière des éléments à fort pouvoir catalytique présente dans les catalyseurs[14]. La synthèse des catalyseurs bimétalliques à l’échelle nanométrique nous a permis d’accéder à des nouvelles propriétés catalytiques distinctes de leurs homologues massifs du fait des effets de surface et de taille finie, et donc bénéficier d’un effet de synergie entre les deux métaux présents dans le catalyseur. Ceci est particulièrement vrai dans les structures de type « cœur-coquille »[14]. De telles structures dont la coquille est formée d’un métal catalytiquement actif et le cœur d’un métal magnétique, sont actuellement très recherchées.
Étant donné que les réactions catalytiques se produisent à la surface des nanoparticules, une très grande proportion des atomes est gaspillée durant le processus. Les métaux catalyseurs sont généralement assez coûteux, c'est le cas du Palladium (Pd) et du Platine (Pt). Afin de réduire ces coûts, la synthèse de nanocatalyseurs présente donc un intérêt considérable. Dans ce cas, le couplage d'un premier métal relativement peu coûteux (Co, Ni, Cu) avec un métal plus coûteux, et plus catalytiquement actif (Pd ou Pt) présente des nombreux avantages économiques. L'efficacité est d’ailleurs d’autant plus grande quand les deux métaux constituants le nano-alliage interagissent l’un vis-à-vis de l’autre, d’où l’intérêt de faire des choix judicieux des deux composants du système bimétallique[15].
La catalyse hétérogène se produit généralement à la surface des échantillons de métal. En effet lorsqu'une molécule s'approche d'une surface, elle peut ressentir l'attraction des atomes de surface. Cette attraction peut provoquer le piégeage dans un puits de potentiel situé à proximité immédiate de la surface. Ce processus est appelé adsorption. Il a été montré par Norskov et Hammer en 1995 que c'est le couplage entre les orbitales d du métal et les orbitales de l’adsorbat qui définit la force de leur interaction. En effet, cette approche a mené à bien décrire le couplage du niveau d’énergie de l’adsorbat avec les électrons des bandes s et p qui conduit à un élargissement et à un abaissement de son énergie. Par conséquent, cela permet d'interagir avec la bande étroite d en donnant un état liant encore plus bas en énergie et un état anti-liant plus élevée dont l’occupation va dépendre du remplissage de la bande d[16]. De là, Hammer et Nirskov ont pu établir que la chimisorption dépend du remplissage des orbitales antiliantes, de sorte que plus ces orbitales sont en dessus du niveau de Fermi, plus elles sont vides et plus la chimisorption est forte[16].
La catalyse par des nano-alliages métalliques offre des intérêts autant pour l’environnement que pour l’industrie, et elle est considérée actuellement comme agent pour lutter contre la pollution. Par exemple, la présence d’atomes de platine à la surface de nano-alliages or-platine permet de sélectionner une réaction particulière, celle de la catalyse de l’oxydation à basse température de monoxyde de carbone (CO) en dioxyde de carbone (CO2). Le premier est mortel, alors que le second est beaucoup moins toxique. Précisément, le CO est mortel pour une teneur de 1 000 ppm (0,1 %) et entraîne le décès en une heure. Il est a rappeler toutefois que le CO2 est un gaz à effet de serre[17].
Il a été démontré que les nano-alliages AuPt supportés par la silice avec une surface enrichie en Or présentent une activité catalytique améliorée par rapport à leurs homologues monométalliques. En effet sous exposition au CO, on remarque un réarrangement de structure avec une migration de Pt vers la surface ainsi qu’un transfert de charge de Au à Pt qui augmente la densité électronique de Pt. Cette densité électronique tend à diminuer la force de la liaison Pt – CO car le CO est connu pour être une base faible, et donc entraîne une diminution de la couverture en CO favorisant l'adsorption dissociative d'O2 suivie d'une réaction avec le CO adsorbé sur Pt et peut aussi être sur Au, c'est-à-dire favoriser la cinétique d'oxydation du CO[18].
En optique

Les propriétés optiques des nano-alliages varient en fonction de la taille des nanoparticules car c’est ce qui définit l’aspect des niveaux d’énergie. Si les nanoparticules sont très petites comparées à la longueur d'onde incidente, on peut comparer ce modèle à un système avec de très petites molécules qui possèderaient des niveaux d’énergie bien séparés permettant d’obtenir des pics d’absorption bien définis. Si les nanoparticules sont de tailles intermédiaires mais toujours plus petites que la longueur d’onde, les propriétés seront similaires à celles d’un cristal avec des bandes d’énergie et non des niveaux bien définis ; les propriétés optiques proviennent d’un phénomène de résonance de plasmon[19]. Si les nanoparticules sont très grandes, c’est-à-dire que la taille de la particule est du même ordre de grandeur que la longueur d’onde incidente, dans ce cas le phénomène de résonance de plasmon de surface est toujours présent mais est moins précis.
Ce phénomène est provoqué par l’excitation d’électrons de la bande de conduction lorsqu'un rayon incident touche l’alliage. Ce rayon agit comme un champ électromagnétique provoquant une oscillation des électrons avec une certaine longueur d’onde, ce mouvement influe sur les ions de la particule créant ainsi un dipôle entre les charge positive et négative. Cette longueur d’onde est donc absorbée lorsque reçue par les électrons et provoque une excitation collective (résonance) des électrons de la bande de conduction : c’est le surface plasmon mode, qui permet d’obtenir un pic d’absorption bien défini. On observe donc finalement un changement de couleur lié à l’absorption de certaines longueurs d’onde et au mouvement des pic de résonance[20].
Cela peut être utilisé dans le cadre de détection d’éléments spécifique en utilisant un métal fonctionnalisé qui va capter de la matière et donc voire son indice optique varier, cela va modifier sa résonance et on peut ainsi suivre l’évolution de la concentration d’un élément via la SPR.
_Operations_A.jpg.webp)
En magnétisme
Le magnétisme au niveau atomique est le résultat de la somme des contributions entre le moment magnétique de spin, le moment magnétique orbital de l'électron et le couplage de ces deux moments.
À cette échelle, de nombreux éléments possèdent un moment magnétique non nul. Néanmoins, peu d’éléments massifs gardent cette propriété (fer, cobalt, nickel et quelques terres rares).
Dans un solide métallique, la structure cristalline du réseau diminue considérablement le moment orbital au travers de l’énergie d’anisotropie magnéto-cristalline ce qui tend à réduire l'interaction spin-orbite et ainsi le moment magnétique total[21]. Les états paramagnétiques, diamagnétiques, ferromagnétiques, antiferromagnétiques et ferrimagnétiques dépendent de l’alignement ou non de ces moments magnétiques. Dans un mélange métallique biphasé, le comportement magnétique peut être approximé comme la somme, pondérée par la fraction relative, de l’aimantation de chaque phase. Cependant, dans le cas d’un alliage à une seule phase, cette prédiction n’est plus possible car les propriétés magnétiques dépendent alors de la structure de bande résultante du mélange. Il est alors possible de considérer un modèle de bandes rigides dans lequel la stœchiométrie de l’alliage influence uniquement la position du niveau de Fermi. L’évolution de l’aimantation dans un alliage en fonction du nombre d’électrons de type d est appelée « courbe de Slater-Pauling »[8].
Comme de nombreuses propriétés des matériaux, la réduction des dimensions à l’échelle nanométrique affecte les propriétés magnétiques de la matière.

D’une part, l’augmentation du nombre d’atomes de surface par rapport aux atomes de cœur provoque une exaltation du magnétisme orbital et l’augmentation du couplage spin orbite car les atomes de surface sont moins sensibles à la structure du réseau cristallin. De ce fait, l’énergie d’anisotropie magnéto-cristalline augmente et avec elle le moment magnétique total.

D’autre part, la réduction de la taille des particules entraîne la diminution du nombre de domaines magnétiques (ou domaines de Weiss), ainsi que du nombre de parois de domaines au sein desquels les moments magnétiques subissent une rotation de transition d’un domaine à l’autre. La réduction de la taille de la particule diminue alors la compétition entre les moments magnétiques des domaines et ceux des parois.
En dessous d’un certain rayon critique, la nanoparticule sera considérée comme n’ayant qu’un seul domaine magnétique. Lorsque qu’une nanoparticule ferromagnétique est dans cette configuration, il est possible de voir apparaître un nouvel état magnétique appelé superparamagnétisme. Dû à une énergie d’anisotropie faible devant l’énergie thermique, la valeur du champ coercitif devient nulle et un renversement spontané de l’aimantation est possible. Cette transition thermiquement activée est réversible et la température de transition est appelée température de blocage.
À cela s’ajoute les effets d’alliages spécifiques aux nanoparticules. En effet selon la composition et les proportions en éléments d’alliages dans la nanoparticule, les propriétés peuvent varier significativement et l’étude de leurs propriétés magnétiques nécessitent des études expérimentales propres à chaque type d’alliage[22]. De par la rapidité du phénomène de renversement d’aimantation, les nanoparticules d’alliages métalliques sont largement étudiées dans le cadre du stockage magnétique haute densité et pourraient être l’objet d’applications prometteuses dans le domaine des disques dur. L’utilisation de ces nanoparticules en médecine est un sujet pertinent dans le cadre de la recherche contre le cancer. En effet les propriétés d’hyperthermie magnétique (échauffement des nanoparticules dans un champ magnétique) de certaines nanoparticules peuvent permettre de cibler des cellules cancéreuses et améliorer l’efficacité de la chimiothérapie.
Les nanoalliages sont aussi fréquemment utilisés dans des applications concernant l'opto-électronique ou bien dans des applications en relation avec la médecine (biodiagnostics, cancérologie, santé), du fait de la plus grande résistance, sensibilité et sélectivité qu'offrent les nanoparticules. Tant de caractéristiques que la médecine cherche à améliorer pour ses matériaux[7].
Les nanoalliages sont aussi utilisés en électrochimie, où par exemple les alliages de nanoparticules métalliques peuvent être utilisés dans des générateurs électrochimiques tels que des batteries lithium-ion[23].
Méthodes de synthèse
Il est aujourd'hui possible de synthétiser des nanoalliages. Les agrégats peuvent être générés par plusieurs méthodes différentes : en milieu gazeux, aqueux, sur substrat ou sur une matrice.
Faisceau moléculaire
Le développement des techniques de faisceau moléculaire a permis l’étude des agrégations « libres » dans un environnement d’interaction libre. Ce type de système est appelé « faisceau de grappe »[7].
Les agrégats sont générés par un processus de vaporisation (production des atomes ou de molécules dans la phase gazeuse), par nucléation (condensation initiale des atomes ou de molécules pour former un agrégat de noyau), par croissance (ajout de davantage d’atomes ou de molécules à un noyau déjà formé) et par fusion (rapprochement de petits agrégats pour former des agrégats plus volumineux). Les agrégats peuvent très bien se rétrécir par évaporation ou fragmentation. Dans plusieurs expériences de faisceau de grappe, les agrégats initialement formés subissent une expansion supersonique. Ainsi, dans la région de flux libre, les agrégats peuvent éviter des collisions et des études sur leur propriétés peuvent être menées sur un agrégat isolé[7].
De nombreuses origines d’agrégats sont compatibles avec cette méthode de synthèse. Cela dépend de leur propriétés réfractaires ou volatiles des métaux utilisés mais aussi de leur nature. Alors on peut générer une distribution de taille importante d'agrégats[7].
Les études les plus récentes sont effectuées en condensation de gaz[7].
Réduction chimique
Les particules colloïdales métalliques peuvent être synthétisées par réduction de sels de métaux dissous dans un solvant approprié en présence de tensioactifs tels que citrate, alkylthiols ou thioéther, ou des ligands polymériques comme du polyvinylpyrrolidone (PVP). Cette méthode a été publiée en 1857 par Michael Faraday. Différents types de réduction par voie chimique existent : co-réduction, réduction successive, réduction de co-complexes[7].
Décomposition thermique des complexes de métaux de transition
La décomposition thermique des complexes de métaux de transition de degré de valence faible (des organométalliques avec des agrégats ou des sels de métaux nobles) a été utilisée pour synthétiser de nombreuses nanoparticules mono- ou bimétalliques. Les résultats sont plus intéressants lorsque la thermolyse a été effectuée en présence de ligand tel que le PVP. Les principaux nanoalliages synthétisés récemment par cette méthode sont Ru6Pd6, Ru6Sn, Ru10Pt2, Ru12Ag4, Ru12Cu4par voie de thermolyse douce.
Par ailleurs, la réduction d’alcool de solution contenant AgNo3/PdOx et Cu/Ox/PdOx a permis de générer des colloïdes Pd-Ag et nanoalliage cuivre-palladium Cu-Pd[24].
Implantation d'ion
Les nanoagrégats métalliques sur matrice possèdent des propriétés intéressantes dans les domaines optiques, magnétiques, et catalytiques. Il est particulièrement remarquable que la susceptibilité χ de troisième ordre de l’agrégat soit meilleure que celle de la matrice. L’augmentation de l’indice réfractaire qui dépend de l’intensité pourrait être utile pour une commutation optique. L’implantation séquentielle des ions de deux métaux différents est utilisée pour générer des agrégats bimétalliques. Les nanoalliages Ag-Au, nanoalliage cuivre-palladium Cu-Pd et Cu-Au, sont générés par cette méthode sur silicium utilisant des faisceaux ioniques avec une énergie de 100 keV[7].
Synthèse par voie électrochimique
C'est une méthode polyvalente pour générer des nanoparticules mono- ou bimétalliques dans une solution.
Par exemple, les nanocolloïdes Pd-Ni, Fe-Co et Fe-Ni sont préparés en utilisant deux plaques métalliques d'anode dans une seule cellule d'électrolyse. Les alliages en présence de Pt, Rh, Ru ou Mo, qui sont quasi insolubles en tant qu'anode, peuvent être générés par voie électrochimique en réduisant leurs sels au niveau de la cathode.
Radiolyse
Une radiolyse des solutions aqueuses est une méthode efficace pour réduire des ions métalliques pour générer des alliages mono- ou bimétalliques des métaux de transition. Pour une méthode radiolytique, l'irradiation de l'eau en rayon γ donne lieu à des électrons solvatés qui réduisent les ions métalliques.
Les nanoalliages suivants sont synthétisés par radiolyse : Ag-Au, Cu-Ag, Pd-Ag, Pt-Ag, Pd-Au, Pt-Au, nanoalliage cuivre-palladium Cu-Pd et nanoalliage nickel-platine Ni-Pt.
Dépôt par ablation laser pulsé
Le dépôt par ablation laser est une méthode de synthèse de nanoparticules qui dépend du processus d'interaction laser - matière. Certaines conditions expérimentales telles que la densité d'énergie, la durée d'impulsion laser ou la pression du gaz peuvent influencer sur la formation de films nanostructurés. Son intérêt réside dans la fabrication de nanoalliages à taille et composition contrôlées. Les nanoalliages Co-Pt, Cu-Ag, Au-Pd et Cu-Au sont synthétisés par cette méthode[25].
Autres
D'autres méthodes existent telles que la biosynthèse ou la synthèse par voie sonochimique.
Méthodes de caractérisation
La plupart des méthodes de caractérisation chimique et structurale des matériaux solides sont basées sur les interactions entre un faisceau de rayons et le matériau à étudier. Plusieurs types de rayonnement allant des ondes infrarouges jusqu'aux neutrons sont utilisés pour l'étude des matériaux. Il existe diverses méthodes de caractérisation des nanoalliages telles que :
Diffusion de rayons X aux petits angles (SAXS)
La diffusion de rayons X aux petits angles (SAXS, en anglais Small Angle X-rays Scattering) est une des techniques qui présente le plus d'intérêt pour la caractérisation des nanostructures. En se basant sur cette technique, tout matériau ayant des caractéristiques structurelles à l'échelle du nanomètre (1 à 100 nm) peut être sondé. Ces matériaux peuvent être des échantillons d'objets solides, de poudres, de dispersions liquides pouvant avoir des structures cristallines, semi-cristallines ou amorphes.
Le principe de cette technique consiste en la mesure de l'intensité des rayons X diffusés par un échantillon en fonction de l'angle de diffusion. Comme son nom l'indique, les mesures sont faites à de très petits angles environ entre 0,1 et 5 degrés. En partant de la loi de Bragg : , il est visible que lorsque l'angle de diffusion est décroissant, on arrive à sonder des caractéristiques structurelles de plus en plus grandes. Les mesures de SAXS utilisent une géométrie de transmission très particulière comme configuration expérimentale. Elles procèdent par un rayonnement monochromatique incident très étroit et très intense. Le signal de diffusion est capté par un détecteur haute résolution qui permet d'atteindre une bonne résolution aux petits angles. Le vecteur de diffusion est ainsi défini par :
avec l'angle de diffusion et la longueur d'onde du faisceau incident.
À partir de l'analyse des informations obtenues par la diffusion des rayons X aux petits angles, on peut extraire des informations sur les paramètres suivants : la distribution de la taille des nanoparticules, le comportement des agrégats des nanoparticules, les phases cristallines liquides, la surface spécifique.
Diffusion dynamique de la lumière
La technique de diffusion dynamique de la lumière (en anglais, dynamic light scattering ou DLS) permet de déterminer le diamètre hydrodynamique des particules en suspension, en utilisant leur mouvement brownien comme une signature de leur taille par mesure du coefficient de diffusion D. La gamme de taille est en général de l’ordre de 2 à 3 000 nm[26].

Lors d'une expérience en DLS, l'échantillon contenant les nanoparticules à mesurer est éclairé par un faisceau laser et les fluctuations de la lumière diffusée par les nanoparticules en mouvement brownien sont détectées à un angle de diffusion θ connu par un détecteur de photons rapide. Les avantages de la DLS sont principalement sa rapidité, sa facilité et sa précision pour les suspensions monomodales. Ainsi que le fait qu'il s'agisse d'une méthode de mesure d'ensemble, donnant une bonne représentation statistique de chaque échantillon de nanoparticules. Cette technique est très sensible et reproductible pour les échantillons monodispersés et homogènes. En revanche, une de ses limitations est la préparation et les conditions nécessaires pour que les particules soient en suspension et subissent un mouvement brownien. Les grosses particules diffusent beaucoup plus de lumière et même un petit nombre de grosses particules peuvent masquer la contribution des particules plus petites[27].
Diffraction des rayons X
La diffraction des rayons X (DRX) est une technique utilisable pour la caractérisation des nano-alliages. En règle générale, elle fournit des informations concernant la structure cristalline, la nature de la phase, les paramètres du réseau et la taille des grains cristallins. La composition des nanoparticules peut être déterminée en comparant la position et l'intensité des pics avec les modèles de référence disponibles dans la base de données International Center for Diffraction Data (ICDD). Cependant, cette technique ne convient pas aux matériaux amorphes car les pics DRX sont trop larges pour les particules de taille inférieure à 3 nm[27].
La diffraction des rayons X est la diffusion élastique des photons des rayons X par les atomes dans un réseau périodique. Les rayons X monochromes diffusés qui sont en phase donnent une interférence constructive.

La figure illustre comment la diffraction des rayons X par des plans cristallins permet de dériver des espacements de réseau en utilisant la loi de Bragg :
- d : distance interréticulaire, c'est-à-dire distance entre deux plans cristallographiques
- θ : angle de Bragg = demi-angle de déviation (moitié de l'angle entre le faisceau incident et la direction du détecteur)
- n : ordre de diffraction (nombre entier)
- λ : longueur d'onde des rayons X.
L'angle entre les faisceaux transmis et diffractés sera toujours égal à 2θ. Cet angle peut être obtenu facilement dans des situations expérimentales et les résultats de la diffraction des rayons X sont donc donnés en termes de 2θ. Il est cependant très important de se rappeler que l’angle utilisé dans l’équation de Bragg doit correspondre à l’angle entre le rayonnement incident et le plan diffractant.
Pour la diffraction du premier ordre, n = 1, et connaissant θ et λ, on peut calculer la valeur de d pour un plan particulier. La première étape du diagramme de diffraction des rayons X implique l'indexation des pics DRX, en effet l'indexation signifie l'attribution des indices de Miller correspondants à chaque pic du diagramme de diffraction. Il existe trois méthodes principales pour indexer un diagramme de diffraction :
- comparaison du diagramme DRX mesuré avec la base de données standard (cartes ICDD) ;
- méthodes analytiques ;
- méthodes graphiques.
L'intensité du signal de diffraction est généralement tracée en fonction de l'angle de diffraction 2θ[°], et la longueur d'onde la plus couramment utilisée en DRX est de 1,54 Å (Cu Kα)[28].
Spectrométrie de masse couplée à un plasma inductif
La spectroscopie de masse à plasma à couplage inductif (ICP-MS) est une technique analytique sensible pour identifier et quantifier la composition élémentaire des nanoparticules dans les échantillons aqueux, et fournit, en une seule analyse, une gamme d'informations sur les particules et les échantillons qui n'est généralement pas disponible avec d'autres techniques.
En ICP, les échantillons liquides sont aérosolisés dans un nébuliseur et dirigés à travers une source de chaleur à haute température (par exemple, du plasma d'argon) pour ioniser les éléments en excitant les électrons des atomes individuels. Les atomes ionisés sont ensuite séparés des particules neutres dans une chambre à vide par un guide d'ions et détectés par un spectromètre de masse (MS). Le rapport masse/charge des ions est utilisé pour séparer les éléments et la concentration de chaque élément est déterminée en fonction de la proportion du signal ionique par rapport à un étalon d'étalonnage interne[29].

Les principaux avantages de l'ICP-MS pour la détection, la caractérisation et la quantification des nanoparticules sont liés à sa haute sensibilité et spécificité, qui peuvent fournir des informations supplémentaires par rapport à d'autres techniques telles que la diffusion dynamique de la lumière. L'ICP-MS est également rapide et nécessite peu de préparation d'échantillons par rapport à des techniques telles que la microscopie électronique à balayage ou à transmission (SEM, TEM), la microscopie à force atomique (AFM)[30].
Microscopie électronique
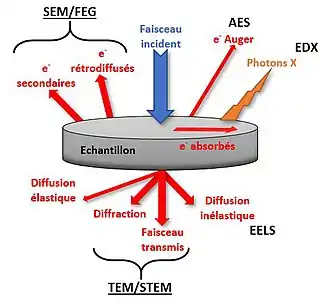
À balayage ou en transmission, la microscopie électronique est une technique d'imagerie basée sur le principe de l'interaction rayonnement-matière dans le cas d'électrons. Contrairement à la microscopie photonique qui utilise un faisceau de photons, en microscopie électronique un faisceau d’électrons primaires est envoyé sur un échantillon placé sous vide poussé. Si l'échantillon est extrêmement fin (de l'ordre de quelques nanomètres), le faisceau pourra le traverser : c'est la microscopie électronique à transmission (MET ou TEM en anglais). Si l'échantillon est trop épais, le faisceau ne pourra pas le traverser. L'intérêt sera alors porté sur les informations accessibles à la surface du matériau : c'est la microscopie électronique à balayage (MEB ou SEM en anglais). L'information recueillie dépendra du faisceau récolté en fonction du type d’interaction entre l'électron et la matière (élastique ou inélastique).
La microscopie électronique à balayage utilise les électrons secondaires et les électrons rétrodiffusés. Ceux-ci apportent une information différente sur la matière dont est constitué l’échantillon et permettent ainsi la reconstruction d’une image en 3D de la surface en nuances de gris.
La microscopie électronique en transmission utilise le faisceau transmis et les faisceaux diffractés. Les électrons sont ensuite collectés sur un écran phosphorescent sur lequel l'image se construit.
La résolution obtenue en microscopie électronique dépend de la longueur d'onde du faisceau d'électrons incident. Cette longueur d'onde est donnée par la longueur d'onde de De Broglie :
- , avec la constante de Planck et la quantité de mouvement de la particule.
Dans le cas d'un électron non relativiste accéléré par un champ électrique, la longueur d'onde de l'électron s'écrit :
avec la masse de l'électron, la charge élémentaire de l'électron en coulombs et l'énergie de l'électron due à la tension d'accélération, en électrons-volts
Soit des longueurs d'onde d'environ 0,1 Å pour une énergie de 20 keV (MEB) et d'environ 0,04 Å pour une énergie de 100 keV (MET). Ces deux techniques sont alors théoriquement possible à utiliser pour sonder la matière à l'échelle de l'atome. Néanmoins en pratique, à cause de problèmes d’aberrations dû à l'appareillage la résolution maximale réelle est autour de quelques nanomètres pour le MEB et quelques dixièmes de nanomètres pour le MET.
Toutes deux peuvent être utilisées dans la caractérisation de nanoparticules ou de nano-alliages car ces techniques offrent des informations complémentaires sur la caractérisation des échantillons.
 Nanoparticules d'or vues en microscopie électronique à balayage mode résolution.
Nanoparticules d'or vues en microscopie électronique à balayage mode résolution. Image de nanoparticules et de nanotubes d'or en microscopie électronique en transmission à haute résolution.
Image de nanoparticules et de nanotubes d'or en microscopie électronique en transmission à haute résolution.
Elles peuvent être couplées à d'autres techniques d'analyses qui utilisent d'autres faisceaux issus de l'interaction entre l'électron et la matière. Les plus courantes sont :
- l'EDS ou analyse dispersive en énergie qui utilise les photons X issus des interactions inélastiques entre les électrons et la matière pour analyser la composition chimique ;
- l'EBSD ou diffraction d'électrons rétrodiffusés qui permet l'analyse cristallographique microstructurale de l'échantillon ;
- l'AES ou la spectroscopie Auger, analyse les électrons Auger créés lors de l'interaction ;
- l'EELS ou la spectroscopie des pertes d'énergie qui détermine la composition chimique avec une grande résolution grâce à l'analyse de la distribution d'énergie des électrons ayant traversé l'échantillon.
Articles connexes
Notes et références
- Aurélie Biancarelli-Lopes, « Modélisation de diagrammes de phase de nanoalliages : application aux systèmes à tendance à l'ordre » [PDF], sur theses.fr,
- « Interfaces, Confinement, Matériaux et Nanostructures - ICMN - GDR Nanoalliages », sur icmn.cnrs-orleans.fr (consulté le )
- Riccardo Ferrando, « Alliages à l'échelle nanométrique : des structures et propriétés fascinantes », sur anneechimie.upmc.fr, (consulté le ).
- (en) Roy Luigi Johnston et Jess P. Wilcoxon, Metal Nanoparticles and Nanoalloys, Amsterdam/Boston, Elsevier, (ISBN 978-0-08-096357-0, lire en ligne), p. 2
- Encyclopædia Universalis, « ALLIAGES », sur Encyclopædia Universalis (consulté le )
- juan, « Simulations Numériques », sur icmmo.u-psud.fr (consulté le )
- (en) Riccardo Ferrando, Julius Jellinek et Roy L. Johnston, « Nanoalloys: From Theory to Applications of Alloy Clusters and Nanoparticles », Chemical Reviews, vol. 108, no 3, , p. 845–910 (ISSN 0009-2665, DOI 10.1021/cr040090g, lire en ligne, consulté le )
- Paul Boyer, Propriétés structurelles et magnétiques d’alliages de nanoparticules fabriquées par procédés lasers pour des applications biomédicales, Montréal, thèse de doctorat, École Polytechnique de Montréal, , 183 p. (lire en ligne), p. 35
- Jean-Gabriel Mattei, Structure et ordre chimique dans les nanoparticules bimétalliques : cas du système immiscible Fe-Bi, Toulouse, thèse de doctorat, université de Toulouse, , 143 p. (lire en ligne), p. 15-18
- « GDR Nanoalliages - Laboratoire Matériaux et Phénomènes Quantiques », sur mpq.univ-paris7.fr (consulté le )
- « Recherche sur la catalyse : au cœur du développement durable | INC », sur inc.cnrs.fr (consulté le )
- « Structure et réactivité des nano-catalyseurs bimétalliques - Laboratoire Matériaux et Phénomènes Quantiques », sur mpq.univ-paris-diderot.fr (consulté le )
- Tsiky Hasiniaina Andriamiharintsoa, Étude de la tendance à l'ordre dans les nanoalliages métalliques à partir de leur structure électronique, Strasbourg,
- Florent Calvo, « Introduction », dans Nanoalloys, Elsevier, (ISBN 978-0-12-394401-6, lire en ligne), xv–xvi
- Konstantin Hadjiivanov, « FTIR study of CO and NH3 co-adsorption on TiO2 (rutile) », Applied Surface Science, vol. 135, nos 1-4, , p. 331–338 (ISSN 0169-4332, DOI 10.1016/s0169-4332(98)00298-0, lire en ligne, consulté le )
- Issam Laoufi, Structure, morphologie et activité catalytique des nanoparticules d’or supportées sur TiO2(110), une étude in operando par GIXD et GISAXS au cours de l’oxydation du CO, Institut NEEL, , p. 17
- « Les propriétés uniques de l’or dans les nanotechnologies : Un nouveau filon pour les scientifiques », sur cnrs.fr
- (en) Rachel P. Doherty, Jean-Marc Krafft, Christophe Méthivie, Sandra Casale, Hynd Remita, Catherine Louis et Cyril Thomas, « On the promoting effect of Au on CO oxidation kinetics of Au–Pt bimetallic nanoparticles supported on SiO2: An electronic effect? », Elsevier, (lire en ligne)
- (en) Riccardo Ferrando, Structure and Properties of Nanoalloys,
- Jimmy Picaud, Biodétection par résonance des plasmons de surface localisés, Université Lille-Nord-de-France,
- Farid Kameche, Assemblage de nanocristaux métalliques, Université Pierre-et-Marie-Curie, thèse de doctorat, , 220 p. (lire en ligne), p. 23-24
- Nicolas Moreau, Croissance et magnétisme de nano-alliages Co(x)Pt(1-x) supportés, Université Pierre-et-Marie-Curie, Thèse de doctorat, , 138 p. (lire en ligne), p. 39-44
- « Physicochimie des Électrolytes et Nanosystèmes interfaciaux - Milieux Liquides Ioniques Basses Températures », sur phenix.cnrs.fr (consulté le )
- (en) C. N. Ramachandra Rao, Giridhar U. Kulkarni, P. John Thomasa et Peter P. Edwardsb, « Metal nanoparticles and their assemblies », Chem. Soc. Rev., vol. 29, , p. 27-35 (DOI 10.1039/A904518J, lire en ligne)
- Mouhamed Diouf, Synthèse de nanoparticules par ablation laser en liquide et étude de leurs propriétés optiques, Lyon,
- Ghestem J.P et Blessing M., Aperçu bibliographique des techniques de caractérisation des nanoparticules dans les eaux, Orléans, , 75 p., p. 31
- (en) Stefanos Mourdikoudis, Nguyen TK Thanh et Roger Molto Pallares, « Characterization Techniques for Nanoparticles: Comparison and Complementarity upon Studying Nanoparticle Properties », ResearchGate, , p. 19/65 (DOI 10.1039/C8NR02278J)
- (en) Ravi Sharma, D.P. Bisen, Usha Shukla et B.G. Sharma, « X-ray diffraction: a powerful method of characterizing nanomaterials », Science and Technology, , p. 77-79 (ISSN 2076-5061, lire en ligne)
- (en) « Nanoparticle Characterization Techniques », sur nanocomposix.com
- (en) Xiaoming Sun, Scott M Tabakman, Won-Seok Seo, Li Zhang, Guangyu Zhang, Sarah Sherlock, Lu Bai et Hongjie Dai, « Separation of Nanoparticles in a Density Gradient: FeCo@C and Gold Nanocrystals », ResearchGate, (PMID 19107884, PMCID PMC2656675, DOI 10.1002/anie.200805047)
- Portail de la chimie
- Portail des sciences des matériaux