Alliage or-cuivre
L'alliage or-cuivre est un alliage issu par fusion de la combinaison entre l'or, de symbole chimique Au, et le cuivre, de symbole chimique Cu, qui est souvent utilisé dans le milieu de la bijouterie. Le but premier d'un alliage est, à partir d'éléments simples, de créer un composé avec des propriétés différentes voire nouvelles. Les phases or-cuivre sont un des alliages ayant été les plus étudiés aujourd'hui[4],[2].
| Alliage Or-Cuivre | |

| |
| Tumbaga pectoral: Alliage Or-Cuivre | |
| Identification | |
|---|---|
| Synonymes |
cupro-alliage, combinaison d'éléments métalliques |
| Apparence | solide, liquide, de couleur dorée et cuivrée |
| Propriétés chimiques | |
| Formule | AuCu pour 50 % at. Cu |
| Masse molaire | 13020 u. pour 50 % at. Cu |
| Propriétés physiques | |
| T° fusion | 910 °C (congruente) [1] |
| Cristallographie | |
| Système cristallin | Cubique à faces centrées[2],[3] |
| Classe cristalline ou groupe d’espace | Fm3m pour (Au,Cu)
Pm3m pour Au3Cu P4/mmm pour AuCu(I) Imma pour AuCu(II) Pm3m pour AuCu3(I) P4mm pour AuCu3(II)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Histoire
L'une des premières traces reportées d'alliage or-cuivre découle de fouilles effectuées lors d'un projet archéologique mené à Maisabel[5]. Ce site a été occupé sur une période allant d'environ à 1200. Ces recherches ont révélé que l'un des plus anciens objets retrouvé présentait un morceau métallique qui n'était autre qu'un alliage, composé d'environ 55 % de cuivre et 40 % d'or (ainsi que de 5 % d'argent). C'est la première trace reportée archéologiquement d'un alliage or-cuivre dans les Indes Occidentales.
En Amérique Centrale et du Sud, les civilisations pré-Colombiennes sont elles aussi connues pour avoir eu l'usage d'alliages or-cuivre et ce majoritairement à des fins décoratives. Tumbaga[1] est le nom donné à cet alliage par les conquistadors. On retrouve ici aussi quelques fois des traces d'argent, considérées comme des impuretés dans l'alliage.
C'est un des premiers alliages pour lesquels des transformations ordre-désordre ont été découvertes et étudiées[2].
Or et cuivre
L'or et le cuivre sont deux éléments chimiques appartenant à la triade cuivre, argent, or, c'est-à-dire que ce sont des composés possédant des propriétés chimiques très voisines[6], ce pouvant expliquer l'existence de l'alliage AuCu. Ils sont tous les deux regroupés dans la famille des métaux de transition et possèdent tous deux une bonne conductivité thermique et électrique et sont résistants à la corrosion. Ils peuvent être utilisés par exemple pour créer des connexions dans différents composants électroniques. Une des différences majeures est leur coût, du fait de la rareté de l'or, son coût est plus élevé. Le cuivre étant plus abondant en milieu naturel.
Intérêt et utilisation de l'alliage
C'est un alliage 100 % métallique qui permet de réduire la quantité d'or utilisée et donc d'abaisser le coût de production, le tout en améliorant l'instabilité du cuivre[7].
L'utilisation de l'alliage or-cuivre a largement évolué avec le temps. Il était autrefois essentiellement utilisé pour la décoration d'objets. Il a été ensuite plus récemment utilisé dans le milieu de la bijouterie, qui est l'une de ses principales applications. Mais dernièrement, l'alliage AuCu émerge dans le domaine des nanosciences, où il est utilisé comme catalyseur de réactions chimiques[1].
À l'échelle nanométrique, les nanoalliages or-cuivre sont aussi utilisés dans le domaine de la catalyse, notamment dans la réaction d'oxydation du monoxyde de carbone en CO2; mais aussi dans le domaine de l'optique, tel que pour la forte résonance plasmon de surface[8].
Synthèse
L'alliage or-cuivre peut être créé naturellement par des procédés géologiques très longs[9]. Néanmoins, il peut être maintenant synthétisé par fusion, en laboratoire. Sa forme nanométrique, quant à elle, est générée par la méthode de l'implantation d'ion[10].
Propriétés de l'alliage
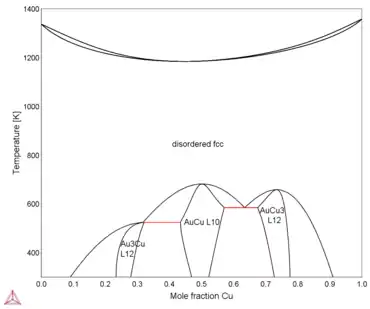
Échelle normale
L'une des propriétés principales de l'alliage est la création de composés intermétalliques (Au3Cu, AuCu, AuCu3). Ces composés sont des phases ordonnées qui se forment selon la composition de l'alliage à basse température: inférieure à 450 °C[2]. Il a été en réalité mis en évidence qu'il existait 2 phases autour de AuCu (I et II), mais les diagrammes de phase sont souvent simplifiés aux seuls 3 composés énoncés plus haut. De même pour la phase AuCu3. À une température supérieure à celle pour laquelle on obtient les phases ordonnées, on a une solution solide d'or et de cuivre pour toutes les compositions de l'alliage[1]. Cela veut dire qu'à haute température, l'or et le cuivre sont totalement miscibles en toutes proportions. On peut parler d'un système bimétallique modèle pour l'alliage Au-Cu[8].
Cet alliage possède un point de fusion congruent à température basse, c'est-à-dire qu'il passe d'une phase solide à une phase liquide facilement, sans changement de composition à l'intérieur de l'alliage; c'est ce qui fait d'ailleurs sa popularité[1]. Pour sa forme désordonnée, l'alliage AuCu possède une fusion congruente à 910 °C avec une composition de 44 % atomique en cuivre. Il permet aussi un abaissement de la température du point de fusion. En effet, le point de fusion du cuivre pur est à 1 084 °C et celui de l'or est à 1 064 °C, largement supérieur à la fusion congruente énoncée.
Échelle nanométrique
Le diagramme de phases expérimental de l'alliage à l'échelle nanométrique n'est pas connu car l'étude de la calorimétrie pour les nanoparticules reste encore compliquée. Seules des approches théoriques peuvent être considérées[8],[1]. Les nanoparticules composant le système ont une taille très petites pouvant être inférieure à 10 nanomètres. Elles peuvent avoir différentes formes géométriques telles que par exemple l'icosahèdre, le cube, l'octahèdre, le décahèdre, le dodécahèdre et l'octahèdre tronqué. Parmi celles-ci, le dodécahèdre, l'octahèdre tronqué et l'icosahèdre sont les structures les plus stables. L'effet de la réduction de taille sur l'alliage or-cuivre va abaisser considérablement sa température de fusion congruente et la déplacer à une composition de l'alliage plus riche en Cuivre[1].
Notes et références
- Grégory Guisbiers, Sergio Mejia-Rosales, Subarna Khanal et Francisco Ruiz-Zepeda, « Gold–Copper Nano-Alloy, “Tumbaga”, in the Era of Nano: Phase Diagram and Segregation », Nano Letters, vol. 14, no 11, , p. 6718–6726 (ISSN 1530-6984, DOI 10.1021/nl503584q, lire en ligne, consulté le )
- (en) H. Okamoto, D.J. Chakrabarti, D.E. Laughlin et T.B. Massalski, Bulletin of Alloy Phase Diagrams, Vol.8, No. 5, (lire en ligne), The Au-Cu (Gold-Copper) System, pages 458, 455, 454
- http://www.sciencedirect.com/science/article/pii/0001616060900353%7Cpage p. 489
- (en) Charlotte L. Bracey, Peter R. Ellis et Graham J. Hutchings, « Application of copper–gold alloys in catalysis: current status and future perspectives », Chemical Society Reviews, vol. 38, no 8, (ISSN 1460-4744, DOI 10.1039/B817729P, lire en ligne, consulté le )
- Peter E. Siegel et Kenneth P. Severin, « The First Documented Prehistoric Gold-Copper Alloy Artefact from the West Indies », Journal of Archaeological Science, vol. 20, no 1, , p. 67–79 (DOI 10.1006/jasc.1993.1005, lire en ligne, consulté le )
- « La classification périodique de Lavoisier à Mendeleïev | CultureSciences-Chimie », sur culturesciences.chimie.ens.fr (consulté le )
- (en) Rong He, You-Cheng Wang, Xiaoyong Wang et Zhantong Wang, « Facile synthesis of pentacle gold–copper alloy nanocrystals and their plasmonic and catalytic properties », Nature Communications, vol. 5, , ncomms5327 (DOI 10.1038/ncomms5327, lire en ligne, consulté le )
- Nouvelles perspectives dans l'alliage de l'or et du cuivre à l'échelle nanométrique, Hélène Prunier
- « PHASE RELATIONS IN THE SYSTEM Au–Cu–Ag AT LOW TEMPERATURES, BASED ON NATURAL ASSEMBLAGES », sur citeseerx.ist.psu.edu (consulté le )
- (en) Riccardo Ferrando, Julius Jellinek et Roy L. Johnston, « Nanoalloys: From Theory to Applications of Alloy Clusters and Nanoparticles », Chemical Reviews, vol. 108, no 3, , p. 853 (ISSN 0009-2665, DOI 10.1021/cr040090g, lire en ligne, consulté le )
- Portail de la chimie