Kétamine
La kétamine est un psychotrope utilisé comme anesthésique général. Elle est aussi employée comme analgésique, sédatif, en traitement des douleurs chroniques et en médecine vétérinaire.
| Kétamine | |
 Structure de la kétamine Structure de la molécule (animation)
|
|
| Identification | |
|---|---|
| Nom UICPA | (RS)-2-(2-chlorophényl)-2-méthylamino-cyclohexan-1-one |
| No CAS | (racémique) (D) ou R(+) (L) ou S(–) |
| No ECHA | 100.027.095 |
| No CE | 229-804-1 |
| No RTECS | GW1400000 (chlorhydrate) |
| Code ATC | N01, N01 |
| DrugBank | DB01221 |
| PubChem | 3821 |
| ChEBI | 6121 |
| SMILES | |
| InChI | |
| Apparence | Poudre cristalline • Solution limpide |
| Propriétés chimiques | |
| Formule | C13H16ClNO [Isomères] |
| Masse molaire[1] | 237,725 ± 0,014 g/mol C 65,68 %, H 6,78 %, Cl 14,91 %, N 5,89 %, O 6,73 %, |
| pKa | 7,5[réf. souhaitée] |
| Propriétés physiques | |
| T° fusion | 262 °C[2],[3] |
| Précautions | |
| SGH[4] | |
 Attention |
|
| Données pharmacocinétiques | |
| Biodisponibilité | Orale : ~17 % IM : ~93 %[réf. souhaitée] |
| Métabolisme | Hépatique |
| Demi-vie d’élim. | 2,5 à 3 h[réf. souhaitée] |
| Excrétion |
Urinaire (90 %)[réf. souhaitée] |
| Considérations thérapeutiques | |
| Classe thérapeutique | Anesthésique général • Antidepresseur • Analgésique |
| Voie d’administration | Orale, IV, IM |
| Conduite automobile | Dangereuse |
| Caractère psychotrope | |
| Catégorie | Hallucinogène dissociatif |
| Mode de consommation |
Insufflation, IV, IM, inhalation, oral |
| Autres dénominations |
Kéta, Ké, Ket, K, Spécial K, Spé, Poney gris, Poudre d'ange, Ketty, Kit kat, Vitamine K (à ne pas confondre avec la Vitamine K) |
| Risque de dépendance | Très élevé si usage non thérapeutique |
| Unités du SI et CNTP, sauf indication contraire. | |
| Kétamine | |
| Noms commerciaux |
Médicament classé stupéfiants
|
|---|---|
| Classe | Anesthésique général Antidepresseur |
| Autres informations | Sous classe : Anesthésique dissociatif |
| Identification | |
| No CAS | |
| No ECHA | 100.027.095 |
| Code ATC | N01AX03 |
| DrugBank | 01221 |
Elle doit absolument être évitée en post-opératoire (tout particulièrement dans la sphère ORL ou en dentisterie). En effet, en tant qu’inhibiteur de l’acide glutamique, elle ralentit (voire empêche) le drainage lymphatique des tissus mous, ce qui peut augmenter la douleur après la prise alors que la kétamine l’avait brièvement atténuée, la guérison s’en trouve considérablement retardée voire empêchée (complications graves après interventions dentaires ou en maxillo-facial, ou après intervention sur des articulations), elle peut provoquer des états fébriles intermittents en cas d’abus chronique.
Aux États-Unis, elle est commercialisée depuis comme antidépresseur sous le nom de Spravato (Laboratoires Janssen), en spray nasal[5].
D'un point de vue pharmacologique, elle est une amine dissociative qui agit comme inhibiteur du glutamate au niveau des récepteurs NMDA, mais son effet est dû en majorité à la conséquence du blocage de ces récepteurs, à savoir l'activation maintenue de récepteurs AMPA[6]. Elle est très proche de la phéncyclidine (PCP) et ressemble au dextrométhorphane au niveau pharmacologique.
Elle fait partie de la liste modèle des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[7].
En psychopharmacologie, elle fait l'objet de recherches pour son puissant effet antidépresseur. Les résultats étaient encore incomplets jusqu'en 2017[8],[9],[10] puis sérieusement documentés entraînant son approbation par la FDA américaine dans le traitement de la dépression.
La kétamine est aussi utilisée de manière détournée pour ses fortes propriétés stupéfiantes, en milieu festif notamment.
Indications
Anesthésie
L'anesthésie représentait l'usage principal de la kétamine jusqu'à son développement en tant qu'antidépresseur. Ses effets anesthésiques sont très différents d'une espèce à l'autre. Chez l'homme, elle provoque peu d'effets sur le système cardiovasculaire et permet de maintenir une respiration spontanée relativement efficace ainsi que des réflexes de toux. Aussi, elle est utilisée en anesthésie de guerre et dans les situations où il n'existe pas de matériel de réanimation ou de personnel expérimenté, en particulier dans les pays du Tiers Monde. Elle est également utile lors d'interventions en haute altitude[11], où les opioïdes exercent une dépression respiratoire trop importante pour la pression partielle en oxygène, qui nécessite des infrastructures importantes.
Dans ces pays, elle est particulièrement utilisée pour la chirurgie en urgence ou la césarienne.
Elle provoque une anesthésie dite « dissociative » (dissociation entre le cortex frontal et le reste du cerveau) responsable des rêves, des fièvres peu importantes et passagères, ainsi des possibles hallucinations lors de la période de réveil. Les hallucinations sont atténuées par l'administration concomitante d'autres drogues, en particulier les benzodiazépines. Les hallucinations sont également moins fréquentes chez les petits enfants et les personnes âgées.
Même en présence de personnel expérimenté, elle est aussi employée en raison de son coût plus faible que les autres analgésiques, dont le prix les rend inaccessibles aux pays en voie de développement.
Dépression
Elle constitue la première évolution majeure dans le traitement de la dépression depuis le Prozac[5]. Elle est commercialisée depuis mars 2019 sous le nom de Spravato (Laboratoires Janssen). En , ce même laboratoire a déposé une demande d'autorisation de mise sur le marché auprès de l’Agence européenne des médicaments. Selon le docteur Michaël Barde, psychiatre à la clinique du Château de Garches, « cette molécule représente une avancée extraordinaire car elle engendre un changement complet de paradigme dans le traitement de la dépression »[12]. Ses propriétés antidépressives étant maintenant bien documentées, la kétamine révolutionne la prise en charge de la dépression sévère[12]. Cette grande efficacité à court-terme serait potentiellement liée à l'activité sur des récepteurs NMDA[8],[10],[13],[14],[15].
Contrairement aux autres antidépresseurs la kétamine se fixe sur les récepteurs NMDA au glutamate ce qui lui confère des propriétés extraordinaires[12].
En France, des protocoles de recherche sont en cours, dont un à l'hôpital Sainte-Anne à Paris dirigé par le docteur Pierre de Maricourt[12].
Par ailleurs, la kétamine possède aussi un effet antisuicide quasiment immédiat[16]. Le docteur Pierre de Maricourt, chef de service de psychiatrie au centre hospitalier Sainte-Anne, à Paris, indique ainsi : « Dès 40 minutes après l’injection, la diminution du risque suicidaire est très significative[12] ».
Son mécanisme reposant sur le système glutamatergique, par opposition à monoaminergique pour les antidépresseurs conventionnels, en fait une nouvelle possibilité de traitement pour les personnes résistantes aux monoamines, c'est-à-dire un tiers des malades[5]. De plus, son effet antidépresseur à court terme pourrait être intéressant en cas de crise suicidaire[17], les antidépresseurs ISRS n'agissant par exemple qu'après un délai de plusieurs semaines[18].
Des recherches sont actuellement menées sur son utilité pour traiter aussi la douleur, l'alcoolisme, et la dépendance à l'héroïne et aux autres opiacés. Dès 2009, l'efficacité de la kétamine pour le traitement de ces pathologies est rapportée par le docteur Chambon dans son ouvrage La médecine psychédélique - Le pouvoir thérapeutique des hallucinogènes aux Éditions Les Arènes, notamment en Russie où les expériences spirituelles vécues sous kétamine créent une libération vis-à-vis de l'alcool[19].
Lutte contre la douleur
Cette molécule est utile pour ses effets antalgiques. En effet, ses propriétés anti-hyperalgésie préviennent la tolérance aiguë aux morphiniques et limitent l'apparition de phénomènes douloureux chroniques (allodynie péricicatricielle). Ainsi la kétamine prend une part importante dans la pratique de l'anesthésie générale. Elle peut également avoir un intérêt dans une approche multimodale de certaines douleurs chroniques. Elle reste aussi utilisée en pédiatrie, pour de petites opérations chirurgicales et accessoirement pour le traitement de la migraine.

Médecine vétérinaire
En médecine vétérinaire, elle est utilisée aussi bien pour de grands animaux, comme les chevaux, que pour des opérations chirurgicales sur de plus petits animaux, notamment pour anesthésier chiens, chats, lapins, furets, rats.
La kétamine est particulièrement adaptée aux interventions de courte durée, c’est-à-dire inférieures à 30 min, ou pour une induction avant une anesthésie gazeuse (relai avec de l'isoflurane par exemple). Elle est par exemple souvent employée lors de castrations. Des injections répétées ou une perfusion en intraveineuse vont permettre de prolonger l’anesthésie pendant plusieurs heures. La kétamine n’est généralement pas utilisée seule : il est en effet conseillé d'associer le produit à des anesthésiques injectables ou inhalés, spécifiquement pour des anesthésies douloureuses. Le relâchement musculaire requis pour les procédures chirurgicales ne pouvant être obtenu avec la kétamine seule, des myorelaxants supplémentaires doivent être utilisés en parallèle. Pour améliorer l'anesthésie ou en prolonger les effets, la kétamine peut être associée à des agonistes des récepteurs α2. Lorsque l’on souhaite opérer sous anesthésie générale, il est nécessaire de procéder à une anesthésie fixe (agents injectables uniquement), éventuellement transitoire et sans relai gazeux, pour coucher l’animal. L’utilisation d'un cathéter intraveineux est fortement recommandée pour administrer sans danger et de manière efficace des doses supplémentaires. Chez le cheval, trois agonistes des récepteurs alpha2 associés à la kétamine sont cités : la détomidine, la xylazine et la romifidine. Ces trois associations sont injectées en intraveineuse (pose d’un cathéter, plus facile pour prolonger l’anesthésie). Ces derniers ont pour effet de diminuer la libération de noradrénaline[20], provoquant une inhibition du système parasympathique, et induit une diminution de la vigilance, de la nociception et du tonus musculaire. Ils jouent donc le rôle de myorelaxants, ou sédatifs. La kétamine peut également être associée au diazépam (Valium) lors de l’induction de l’anesthésie générale. La kétamine dispose de deux modes d’administration principalement en médecine vétérinaire : par voie intraveineuse (IV) et intramusculaire (IM). La voie intraveineuse nécessite une dose initiale moins importante qu’en intramusculaire (1 à 4,5 mg/kg contre 6,5 à 13 mg/kg). Une injection intraveineuse de 2 mg/kg détermine une anesthésie durant 5 à 10 minutes, tandis que pour une intramusculaire, une dose de 10 mg/kg provoque une anesthésie durant 12 à 25 minutes. L’injection en intraveineuse doit être pratiquée lentement, afin d’éviter une dépression respiratoire[21]. Une injection en IV sous-entend donc également d’être confronté à un animal qui n’est pas stressé et donc un accès facile à la veine jugulaire à l’encolure chez le cheval. En IV, l’induction de l’anesthésie est enfin plus rapide qu’en IM. C’est au vétérinaire d’aviser selon la situation quel mode d’administration il juge le plus judicieux.
Chimie
À la sortie du système porte, lors de son passage dans le foie, la kétamine est métabolisée par des cytochromes du groupe P450, le CYP2B6 et le CYP3A4 par N-déméthylation en norkétamine, son principal métabolite (actif), à hauteur de 80 % environ. Ces transformations se produisent également -chez l'animal- dans les reins, et le tractus digestif. La kétamine semble être elle-même un effecteur des enzymes qui la métabolisent, exerçant ainsi une rétroaction[22],[23].
Cette dernière est elle-même hydroxylée en 6-hydroxy-norkétamine puis glucurono-conjugué avant d'être éliminée par les urines et la bile. Sa demi-vie d'élimination est ainsi d'environ 2 heures et demie. Certaines recherches semblent montrer une clairance (élimination) de 20 % supérieure chez la femme.
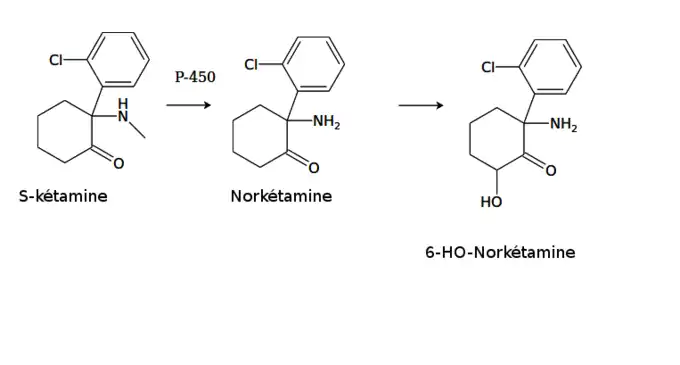
Lors d'une prise par voie nasale, la biodisponibilité est de 50 % et de 20 % par voie rectale.
La voie nasale est souvent utilisée par les usagers de drogue, et elle présente un intérêt potentiel pour l'analgésie.
Elle fait partie de la famille des arylcyclohexylamines. L'atome de carbone qui porte la fonction amine et le groupe chlorophényl est asymétrique. La kétamine se présente donc sous forme de deux énantiomères, de configuration absolue R et S. La kétamine médicale se présente sous la forme de racémate (mélange des deux énantiomères) ou sous la forme S énantiomériquement pure ou eskétamine[24]. Dans les laboratoires clandestins, il n'est pas rare de la rencontrer sous la forme S, celle-ci ayant des effets plus appréciés par les consommateurs récréatifs.
Il est possible de synthétiser la kétamine à partir du bromocyclopentane et de l'ortho-chlorobenzonitrile[3].
Sous sa forme de chlorhydrate, elle se présente comme une poudre cristalline soluble dans l'eau, l'éthanol, le méthanol, faiblement dans le chloroforme et pratiquement pas dans l'éther. Les deux énantiomères de la base libre arkétamine ou R-kétamine et eskétamine ou S-kétamine sont respectivement dextrogyre et lévogyre. Le sens de rotation du pouvoir rotatoire est inversé dans les sels chlorhydrate c'est-à-dire que le chlorhydrate d'arkétamine est lévogyre tandis que celui d'eskétamine est dextrogyre. Comme le chlorhydrate d'eskétamine est un composé de base médical, des cliniciens on pris l'habitude de le noter « S-(+)-kétamine », ce qui peut provoquer une certaine confusion si on ne sait pas que cette notation réfère obligatoirement au chlorhydrate et ainsi également pour la notation « R-(–)-kétamine » qui correspond au chlorhydrate d'arkétamine.
Pharmacologie
Pharmacocinétique
La kétamine est plutôt bien absorbée dans le tube digestif, grâce à une grande liposolubilité[25].
Elle se lie en revanche faiblement aux protéines plasmatiques (20 %) et subit un fort effet de premier passage hépatique, ce qui lui confère une mauvaise biodisponibilité orale (17 %)[23].
Pharmacodynamie
D'un point de vue psychopharmacologique, il s'agit d'un inhibiteur des récepteurs NMDA du glutamate. Cet effet est observé principalement au niveau du thalamus, de l'hippocampe et du cortex préfrontal, ce qui explique ses effets importants sur la mémoire et la conscience.
Elle induit une dépression thalamonéocorticale et une stimulation limbique. Elle déconnecterait les circuits émotionnels impliqués dans la transmission de la douleur.
La kétamine est un anesthésique à part, cliniquement et d'un point de vue pharmacologique.
Elle est fondamentalement différente d'autres hypnotiques ou agents analgésiques comme le fentanyl et les analgésiques opioïdes, les barbituriques ou les benzodiazépines. En effet, l'anesthésie sous kétamine est qualifiée de « dissociative » et, à l'exact inverse des anesthésiques courants, produit une hypertonie musculaire dose-dépendante, un nystagmus, et induit la conservation des réflexes cornéens et photomoteurs comme le myosis photo-induit. Parfois, une agitation est constatée, et souvent, lors de son emploi en anesthésie, l'on utilise une association avec une benzodiazépine, pour inhiber les hallucinations et l'hypertonie musculaire, lesquelles sont parfois traumatisantes pour le patient, et dangereuses lors d'une opération chirurgicale.
Utilisée à des doses anesthésiques, la kétamine stimule le système circulatoire plutôt que le ralentir[26] et présente ainsi des propriétés hypotensives moindres, contrairement aux benzodiazépines ou aux opioïdes, ce qui induit une hypotension péri-opératoire moins fréquente[27].
De plus, elle est beaucoup moins propice à provoquer une dépression respiratoire ou cardiaque que d'autres antalgiques tels que les morphiniques. Il est ainsi possible de pratiquer une anesthésie sous kétamine sans prendre de mesures de contrôle des voies aériennes. Cependant, cette pratique est de moins en moins courante en France à cause des propriétés psychotropes de la kétamine, qui peut provoquer des hallucinations chez les patients.
Effets à court terme
On observe en général une phase hallucinatoire, dose-dépendante, selon une relation linéaire[28], qui dure de dix à quarante minutes[29] en cas de prise par voie nasale, qui affecte les sens, le jugement et la coordination motrice pendant quatre à six heures[30].
À fortes doses, elle provoque des altérations de la respiration et peut aussi induire une perte de connaissance voire un coma[31].
Des hallucinations et plus généralement des effets psychédéliques[32] sont présents à des doses sub-anesthésiques. Les hallucinations peuvent être ressenties comme traumatisantes, ce qui motive souvent l'emploi associé de benzodiazépines en anesthésiologie.
Certains relatent des expériences de décorporation ou d'expérience de mort imminente[29], et lorsque la dose est importante, et que les doses deviennent péri-anesthésiques, les usagers récréatifs de la kétamine décrivent un « K-Hole » qui correspond à la sédation recherchée en anesthésie.
Le K-hole est une sorte de « trou noir » avec troubles cognitifs et amnésiques, troubles de l'humeur et du comportement, délires hallucinatoires, cauchemars, perte d'identité et du contact à la réalité. Il est caractérisé (par les usagers) par une impression de se retrouver profondément dans son esprit, le monde terrestre semblant distant (d'où l'expression hole, trou en anglais, pour décrire cette sensation)[33],[34].
Sans surveillance médicale, le K-Hole peut mener à une dépression respiratoire, au coma, et à la mort en cas de doses importantes.
Ses effets hallucinogènes sont amplifiés par de fortes stimulations sensorielles[29].
L'impression de dissociation entre le corps et l'esprit laisse l'usager sans défense, doublée de l'effet analgésique. Ainsi un usager de kétamine peut se blesser sans en prendre conscience.
En cas de nausées ou de vomissements, un risque d'étouffement par fausse route est possible du fait de l'incoordination motrice qu'entraîne le produit.
La « descente » — fin des effets — est subite et brusque[19].
Les patients traités à la kétamine rapportent des expériences d'états altérés de conscience (expérience de dédoublement), alors qu'ils étaient sous anesthésie. De tels effets secondaires psychodysleptiques ont rendu son usage moins fréquent.
En tant qu'anesthésiant, elle pose d'autres problèmes comme l'absence de profondeur de l'anesthésie et des effets secondaires comme des migraines, des nausées, des vomissements, une confusion ou une sensation d'irréalité sont décrits[32].
Effets à long terme
Les données cliniques concernant l'usage à long terme de la kétamine ne sont pas complètes ; en effet, la kétamine est un psychotrope de synthèse relativement récent.
La kétamine semble être neurotoxique, impactant gravement le développement neuronal chez le rongeur[35],[36], provoquant des anomalies de la microstructure de la substance blanche chez le singe[37].
Cet effet neurotoxique important semble majoré au jeune âge, provoquant ainsi chez de nombreux modèles animaux des changements de la structure cérébrale[38],[39]. La kétamine passe la barrière placentaire[40],[41], et semble être extrêmement toxique pour le fœtus humain, provoquant des anomalies de croissance, une hypotonie post-natale et une aréflexie[42],[40].
Elle peut provoquer une forte dépendance psychique.
Il existe un effet retour ou flash back qui replace brièvement l'usager dans l'état généré par la consommation de kétamine sans en consommer, et ce plusieurs mois après la dernière prise[43].
Elle entraîne également une inflammation sévère des voies urinaires et plus particulièrement de la vessie. Cela peut aboutir à une nécrose papillaire, une insuffisance rénale et à une diminution de la capacité vésicale secondaire à une cystite interstitielle chronique (aseptique). Les symptômes sont alors des douleurs et brûlures urinaires associées à une pollakiurie sévère. L'arrêt de la prise de kétamine permet d'améliorer les symptômes mais des cas de diminution définitive de la taille de la vessie ont été rapportés ayant nécessité de remodeler la vessie avec du tube digestif (agrandissement vésical)[44].
Cette importante toxicité à long terme contraste avec une relative innocuité lors d'un usage ponctuel, lors de l'anesthésie par exemple.
À long terme, les propriétés antidépressives de la kétamine semblent plafonnées[13].
Interactions
L'utilisation combinée de kétamine avec d'autres produits peut être dangereuse. L'alcool, notamment, augmente les risques de dépression respiratoire et ajoute aux effets à long terme de la kétamine ceux de l'alcool[45].
Effets recherchés
- Altération de la perception de l'environnement et de la réalité : sensation que son environnement est irréel
- Sensation de chaleur ;
- Légère euphorie ;
- Sensation d'apaisement, de flottement (cotonneux) et de tranquillité (effet sédatif) ;
- Diminution de l'anxiété (effet anxiolytique) ;
Effets à court terme
- Ralentissement de la fréquence cardiaque (bradycardie) et respiratoire[46] ;
- Hypotension artérielle [46] ;
- Somnolence
- Perte de coordination et de l'équilibre[19] ;
- Nausées, vertiges, vomissements (surdose)[46] ;
- Perte de connaissance et/ou perte de conscience (K-Hole), évanouissement ou coma (surdose) [46].
Usage détourné
La kétamine vendue illégalement provient de sources légitimes détournées, mais elle est aussi synthétisée dans des laboratoires clandestins[43]. Elle se présente soit sous la forme d'une poudre cristalline, soluble dans l'eau ou dans l'alcool, soit sous forme liquide[30].
Les modes d'usage les plus répandus sont l'inhalation communément appelé le « sniff » et l'ingestion après dilution dans un liquide, comme de l'eau ou de l'alcool[19].
Mais il est aussi possible de l'ingérer sous forme solide, en injection (IV, IM) ou en plug.
Les effets sont très variables suivant la dose, les drogues associées, d'un individu à l'autre et chez un même individu suivant son état d'esprit au moment de la prise. John Cunningham Lilly, David Woodard et D.M. Turner (entre autres) ont beaucoup écrit sur leurs propres expériences psychonautiques avec la kétamine[47]:288–295.
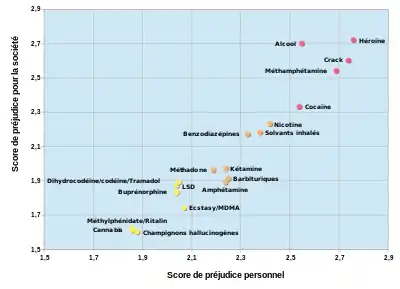
Histoire et société
Historique
Elle a été synthétisée pour la première fois par Calvin Stevens (en) en 1962 pour les laboratoires Parke-Davis[43].
En effet, ces laboratoires étaient à la recherche de l'agent anesthésique « parfait », plus pratique que les morphiniques, avec moins d'effet secondaires, notamment sur la fonction respiratoire, et possédant des propriétés analgésiques[49].
Dans la famille des cyclohexylamines, la phéncyclidine (PCP) est découverte en premier, et testée sur des singes, puis sur l'homme pour la première fois en 1958[50]. Malgré une analgésie significative, des effets secondaires importants — comme l'agitation ou l'apparition de convulsions — furent immédiatement rapportés[51]. La PCP fut alors utilisée majoritairement comme anesthésique vétérinaire, et fit l'objet d'un trafic important pour ses fortes propriétés stupéfiantes[52].
Isolée parmi de nombreux dérivés de la PCP par Calvin Stevens, la kétamine fut testée sur des prisonniers, puis sur de nombreux sujets, conduisant à sa mise sur le marché (pour la médecine humaine et vétérinaire) en 1966[43]. Sa commercialisation se fit dès 1969 aux États-Unis. Le professeur Edward Domino la décrit alors comme « anesthésiant dissociatif[19]. »
La kétamine fut utilisée durant la guerre du Viêt Nam sur de nombreux soldats, augurant ainsi le début de son usage en médecine de catastrophe, et de son usage toxicomaniaque dans un contexte de révolution psychédélique, à la suite de la publication en 1978 d'ouvrages de trip-report.
Ses indications se précisèrent dans le courant des années 1970, et l'on commença à associer des benzodiazépines comme le diazépam à la kétamine pour limiter ses effets secondaires psychodysleptiques[53], association encore largement utilisée de nos jours[54],[55].
Sa pharmacocinétique fut explorée et ses indications de choix furent posées : (asthme aigu grave, grands brûlés, urgence et situation de crise, traumatismes crâniens avec augmentation de la pression intracrânienne).
Cependant, ses effets hallucinogènes et psychédéliques et sa supplantation par d'autres hypnotiques, comme le midazolam conduisirent à sa mise à l'écart pendant plus de cinquante ans.
Classé au tableau III des stupéfiants aux États-Unis dès 1999 et au tableau B des stupéfiants en France dès 1997 par arrêté, la kétamine a connu un regain d'intérêt dans les années 2000, dans le cadre d'une prise en charge algologique multimodale.
Son usage en algologie représente une hypothèse de travail actuelle, mais se heurte à de nombreux effets secondaires.
Législation
La kétamine a été placée sur la Liste III de la loi sur les substances contrôlées aux États-Unis en août 1999. Dans de nombreux pays, la kétamine est considérée comme un stupéfiant, et son utilisation hors d'un cadre médical est répréhensible.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Le chlorhydrate de kétamine possède un point de fusion de 262 °C.
- (en) « Synthesis of Ketamine »
- « SMF article - Schweizerisches Medizin - Forum », sur medicalforum.ch (consulté le )
- (en) WHO Model List of Essential Medicines, 18th list, avril 2013
- Eunice Yuen, Steven Swanson et Jeffrey M. Witkin, « Prediction of human efficacious antidepressant doses using the mouse forced swim test », Pharmacology, Biochemistry, and Behavior, vol. 161, , p. 22–29 (ISSN 1873-5177, PMID 28888484, DOI 10.1016/j.pbb.2017.09.002, lire en ligne, consulté le )
- Chittaranjan Andrade, « Ketamine for Depression, 5: Potential Pharmacokinetic and Pharmacodynamic Drug Interactions », The Journal of Clinical Psychiatry, vol. 78, no 7, , e858–e861 (ISSN 1555-2101, PMID 28858450, DOI 10.4088/JCP.17f11802, lire en ligne, consulté le )
- Weili Zhu, Zengbo Ding, Yinan Zhang et Jie Shi, « Risks Associated with Misuse of Ketamine as a Rapid-Acting Antidepressant », Neuroscience Bulletin, vol. 32, no 6, , p. 557–564 (ISSN 1995-8218, PMID 27878517, PMCID PMC5567488, DOI 10.1007/s12264-016-0081-2, lire en ligne, consulté le )
- R. A. Bishop, J. A. Litch et J. M. Stanton, « Ketamine anesthesia at high altitude », High Altitude Medicine & Biology, vol. 1, no 2, , p. 111–114 (ISSN 1527-0297, PMID 11256562, DOI 10.1089/15270290050074251, lire en ligne, consulté le )
- Cécile Thibert, « La kétamine révolutionne la prise en charge de la dépression sévère » sante.lefigaro.fr, publié le 27 février 2018.
- Yinghong Jiang, Yiqiang Wang, Xiaoran Sun et Bo Lian, « Short- and long-term antidepressant effects of ketamine in a rat chronic unpredictable stress model », Brain and Behavior, vol. 7, no 8, , e00749 (ISSN 2162-3279, PMID 28828210, PMCID PMC5561310, DOI 10.1002/brb3.749, lire en ligne, consulté le )
- Linda Nguyen, Anna L. Scandinaro et Rae R. Matsumoto, « Deuterated (d6)-dextromethorphan elicits antidepressant-like effects in mice », Pharmacology, Biochemistry, and Behavior, (ISSN 1873-5177, PMID 28916283, DOI 10.1016/j.pbb.2017.09.005, lire en ligne, consulté le )
- Paul Glue, Natalie J. Medlicott, Sarah Harland et Shona Neehoff, « Ketamine's dose-related effects on anxiety symptoms in patients with treatment refractory anxiety disorders », Journal of Psychopharmacology (Oxford, England), , p. 269881117705089 (ISSN 1461-7285, PMID 28441895, DOI 10.1177/0269881117705089, lire en ligne, consulté le )
- Démontré dans une étude publiée en 2009 dans le journal Biological Psychiatry, lire en ligne
- Lael Reinstatler et Nagy A. Youssef, « Ketamine as a potential treatment for suicidal ideation: a systematic review of the literature », Drugs in R&D, vol. 15, , p. 37–43. (ISSN 1179-6901, PMID 25773961, PMCID 4359177, DOI 10.1007/s40268-015-0081-0)
- Inserm, « Comment agit le Prozac ? Les microARNs s’en mêlent… », sur www.inserm.fr (consulté le )
- Michel Hautefeuille et Dan Véléa, Les drogues de synthèse, Paris, Presses universitaires de France, coll. « Que sais-je ? », , 127 p. (ISBN 978-2-13-052059-7)
- FABRICE, HUBERT, BENOIT REYNAUD, « L’ASSOCIATION ROMIFIDINE-NALBUPHINE DANS LA CHIRURGIE DEBOUT CHEZ LE CHEVAL : EVALUATION DE LA SÉDATION. Thèse pour le DOCTORAT VÉTÉRINAIRE », (consulté le )
- « Résumé des caractéristiques du produit - KETAMINE PANPHARMA 250 mg/5 ml, solution injectable (I.V.-I.M.) - Base de données publique des médicaments », sur base-donnees-publique.medicaments.gouv.fr (consulté le )
- Samuel Fanta, Mari Kinnunen, Janne T. Backman et Eija Kalso, « Population pharmacokinetics of S-ketamine and norketamine in healthy volunteers after intravenous and oral dosing », European Journal of Clinical Pharmacology, vol. 71, no 4, , p. 441–447 (ISSN 1432-1041, PMID 25724645, DOI 10.1007/s00228-015-1826-y, lire en ligne, consulté le )
- G. Mion, Kétamine, Arnette, , 280 p. (ISBN 978-2-7184-1317-4, lire en ligne)
- (en) « Ketamine Derivatives »
- (en) Pubchem, « ketamine », sur pubchem.ncbi.nlm.nih.gov (consulté le )
- Yasmina Salmandjee, Les drogues, Tout savoir sur leurs effets, leurs risques et la législation, Paris, Eyrolles, coll. « Eyrolles Pratique », , 223 p. (ISBN 978-2-7081-3532-1)
- Marco Zuin, Gianluca Rigatelli, Fabio Dell'Avvocata et Giuseppe Faggian, « Ketamine and midazolam differently impact post-intubation hemodynamic profile when used as induction agents during emergency airway management in hemodynamically stable patients with ST elevation myocardial infarction », Heart and Vessels, (ISSN 1615-2573, PMID 28889210, DOI 10.1007/s00380-017-1049-5, lire en ligne, consulté le )
- M. Shimoyama, N. Shimoyama, C. E. Inturrisi et K. Elliott, « Oral ketamine produces a dose-dependent CNS depression in the rat », Life Sciences, vol. 60, no 1, , PL9–14 (ISSN 0024-3205, PMID 8995536, lire en ligne, consulté le )
- « Kétamine, effets, risques, témoignages — PsychoWiki, le wiki de Psychoactif », sur www.psychoactif.org (consulté le )
- Amine Benyamina, Le cannabis et les autres drogues, Paris, Solar, , 197 p. (ISBN 978-2-263-03904-1)
- Charles F. Zorumski, Yukitoshi Izumi et Steven Mennerick, « Ketamine: NMDA Receptors and Beyond », The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, vol. 36, no 44, , p. 11158–11164 (ISSN 1529-2401, PMID 27807158, PMCID PMC5148235, DOI 10.1523/JNEUROSCI.1547-16.2016, lire en ligne, consulté le )
- « K-Hole et bad ultime / PsychoACTIF », sur www.psychoactif.org (consulté le )
- (en) « Urban Dictionary: k hole », sur Urban Dictionary (consulté le )
- Yanan Li, Xinran Li, Cen Guo et Lina Li, « Long-term neurocognitive dysfunction in offspring via NGF/ ERK/CREB signaling pathway caused by ketamine exposure during the second trimester of pregnancy in rats », Oncotarget, vol. 8, no 19, , p. 30956–30970 (ISSN 1949-2553, PMID 28415680, PMCID PMC5458180, DOI 10.18632/oncotarget.16042, lire en ligne, consulté le )
- Qi Li, Lin Shi, Gang Lu et Hong-Luan Yu, « Chronic Ketamine Exposure Causes White Matter Microstructural Abnormalities in Adolescent Cynomolgus Monkeys », Frontiers in Neuroscience, vol. 11, , p. 285 (ISSN 1662-4548, PMID 28579941, PMCID PMC5437169, DOI 10.3389/fnins.2017.00285, lire en ligne, consulté le )
- Runtao Ding, Yanning Li, Ao Du et Hao Yu, « Changes in hippocampal AMPA receptors and cognitive impairments in chronic ketamine addiction models: another understanding of ketamine CNS toxicity », Scientific Reports, vol. 6, , p. 38771 (ISSN 2045-2322, PMID 27934938, PMCID PMC5146946, DOI 10.1038/srep38771, lire en ligne, consulté le )
- W. Ma, Y.-Y. Cao, S. Qu et S.-S. Ma, « Remote ischemic preconditioning provides neuroprotection: impact on ketamine-induced neuroapoptosis in the developing rat brain », European Review for Medical and Pharmacological Sciences, vol. 20, no 23, , p. 4972–4979 (ISSN 2284-0729, PMID 27981535, lire en ligne, consulté le )
- Pen-Hua Su, Yan-Zin Chang et Jia-Yuh Chen, « Infant with in utero ketamine exposure: quantitative measurement of residual dosage in hair », Pediatrics and Neonatology, vol. 51, no 5, , p. 279–284 (ISSN 1875-9572, PMID 20951358, DOI 10.1016/S1875-9572(10)60054-X, lire en ligne, consulté le )
- Danja Strümper, Wiebke Gogarten, Marcel E. Durieux et Kristian Hartleb, « The effects of S+-ketamine and racemic ketamine on uterine blood flow in chronically instrumented pregnant sheep », Anesthesia and Analgesia, vol. 98, no 2, , p. 497–502, table of contents (ISSN 0003-2999, PMID 14742394, lire en ligne, consulté le )
- Ansgar M. Brambrink, Alex S. Evers, Michael S. Avidan et Nuri B. Farber, « Ketamine-induced neuroapoptosis in the fetal and neonatal rhesus macaque brain », Anesthesiology, vol. 116, no 2, , p. 372–384 (ISSN 1528-1175, PMID 22222480, PMCID PMC3433282, DOI 10.1097/ALN.0b013e318242b2cd, lire en ligne, consulté le )
- Denis Richard, Jean-Louis Senon et Marc Valleur, Dictionnaire des drogues et des dépendances, Paris, Larousse, , 626 p. (ISBN 978-2-03-505431-9)
- (en) Peggy Sau-Kwan Chu, Wai-Kit Ma, Simon Chun-Wing Wong, Ringo Wing-Hong Chu, Cheung-Hing Cheng, Shun Wong, Johnny Man-li Tse, Fei-Lung Lau, Ming-Kwong Yiu et Chi-Wai Man1, « The destruction of the lower urinary tract by ketamine abuse: a new syndrome? », BJU International, vol. 102, , p. 1616-1622 (DOI 10.1111/j.1464-410X.2008.07920.x, résumé)
- M. S. M. Wai, P. Luan, Y. Jiang et W. M. Chan, « Long term ketamine and ketamine plus alcohol toxicity - what can we learn from animal models? », Mini Reviews in Medicinal Chemistry, vol. 13, no 2, , p. 273–279 (ISSN 1875-5607, PMID 22512581, lire en ligne, consulté le )
- Yasmina Salmandjee, Les drogues, Tout savoir sur leurs effets, leurs risques et la législation, Eyrolles, coll. « Eyrolles Pratique », (ISBN 2-7081-3532-5)
- Woodard, D., « The Ketamine Necromance », dans A. Parfrey, éd., Apocalypse Culture II (Los Angeles: Feral House, 2000), pp. 288–295.
- (en) M. Taylor, K. Mackay, J. Murphy, A. McIntosh, C. McIntosh, S. Anderson et K. Welch, « Quantifying the RR of harm to self and others from substance misuse: results from a survey of clinical experts across Scotland », BMJ Open, vol. 2, no 4, , e000774–e000774 (DOI 10.1136/bmjopen-2011-000774, lire en ligne, consulté le )
- Cazalaà JB, Aspects historiques de l'anesthésie intraveineuse et de la kétamine, In : Kétamine, Georges Mion, Paris, Arnette, , p. 1-8
- (en) Griefenstein FE, « A study if a 1-aryl cyclo hexyl amine for anesthesia », Anesth Analg, (DOI 37:283-94)
- (en) « Twenty-five years of ketamine A report of an international meeting », Anaesthesia, , p. 159-160
- Georges Mion, Kétamine, Arnette, , p. 1-8
- Muhlmann-Weill, « Intérêt de l'association kétamine-diazépam en anesthésie », Anesth Analg Réanim, , p. 29
- (en) Ana M. del Álamo, Ron E. Mandsager, Thomas W. Riebold et Mark E. Payton, « Evaluation of intravenous administration of alfaxalone, propofol, and ketamine-diazepam for anesthesia in alpacas », Veterinary Anaesthesia and Analgesia, vol. 42, no 1, , p. 72–82 (ISSN 1467-2995, PMID 24834969, DOI 10.1111/vaa.12170)
- (en) Carolina H. Riccó et Natalia Henao-Guerrero, « Cardiovascular effects of orotracheal intubation following anesthetic induction with propofol, ketamine-propofol, or ketamine-diazepam in premedicated dogs », Journal of the American Veterinary Medical Association, vol. 244, no 8, , p. 934–939 (ISSN 1943-569X, PMID 24697769, DOI 10.2460/javma.244.8.934)
Voir aussi
Liens externes
- Compendium suisse des médicaments : spécialités contenant Kétamine.
- Page spécifique, sur Le Vidal.fr.
- Portail de la chimie
- Portail de la pharmacie
