Hormone de libération des gonadotrophines hypophysaires
Lulibérine, Gonadolibérine
Pour les articles homonymes, voir GRH.
| Gonadolibérine | |
| |
| Gonadolibérine. | |
| Identification | |
|---|---|
| Synonymes |
gonadoréline |
| No CAS | |
| No CE | 251-553-1 |
| Code ATC | V04 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C55H75N17O13 [Isomères] |
| Masse molaire[1] | 1 182,2901 ± 0,0566 g/mol C 55,87 %, H 6,39 %, N 20,14 %, O 17,59 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
L'hormone de libération des gonadotrophines hypophysaires appelée aussi parfois gonadolibérine (et fréquemment abrégée en GnRH, sigle de l’anglais Gonadotropin Releasing Hormone), est une hormone peptidique synthétisée par des neurones de l’hypothalamus (neurohormone) responsable de la synthèse et de la sécrétion de l'hormone lutéinisante (LH) et, à un degré moindre, de l'hormone folliculo-stimulante (FSH) par l’anté-hypophyse.
Dénominations
Elle est aussi parfois appelée lulibérine[2] et LHRH (de l’anglais Luteinizing Hormone Releasing Hormone).
Gène
Le gène du précurseur de la GnRH est situé chez l'Humain sur le chromosome 8[3]. Il code un précurseur de 92 acides aminés.
Structure
La découverte de la GnRH a été faite en 1977 par Roger Guillemin et Andrew V. Schally, tous deux lauréats du Prix Nobel.
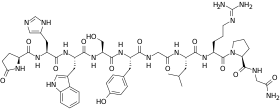
Le précurseur du GnRH est clivé par protéolyse pour donner le GnRH, un décapeptide (autrement dit, un peptide de 10 acides aminés) dont les deux extrémités, N- et C-terminales sont modifiées :
- pyroGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly CONH2
Les modifications des extrémités N- et C-terminales (cyclisation de la glutamine en acide pyroglutamique et amidation du carboxyl terminal) protègent le GnRH de l'attaque des protéases (aminopeptidases et carboxypeptidases respectivement).
Le peptide résiduel du précurseur est appelé GAP (GnRH-Associated Peptide) et sa fonction est inconnue.
GnRH en tant que neurohormone
La GnRH est une neurohormone produite par des neurones spécialisés du noyau arqué de l'hypothalamus. À la puberté, la GnRH est libérée à l'extrémité des terminaisons nerveuses dans le système de circulation porte hypophysaire. Un des signaux qui semble activer la sécrétion de la GnRH par l'hypothalamus semble être la neurokinine B. Elle se fixe alors sur les récepteurs spécifiques à la GnRH de la membrane plasmique des cellules gonadotropes, pour activer des cascades de signalisation intracellulaire. La GnRH est alors dégradée en quelques minutes.
Contrôle de la FSH et de la LH
La GnRH stimule la synthèse et la libération des gonadotrophines FSH et LH au niveau de l'adénohypophyse, processus qui est contrôlé par la fréquence et l'amplitude des oscillations de GnRH, elles-mêmes contrôlées par la quantité d'hormones sexuelles dans le sang (testostérone pour l'homme, œstrogène et progestérone pour la femme). Ainsi, une seule hormone, la GnRH, contrôle un processus complexe permettant le développement d'un follicule ovarien, l'ovulation, et le maintien du corps lutéal (corps jaune) dans le cycle menstruel (cycle sexuel) chez la femme, mais contrôle aussi la spermatogénèse (production de spermatozoïdes dans les tubes séminifères des testicules) chez l'homme.
Ces processus utilisent des rétro-contrôles positifs et négatifs (en fonction du taux de telle hormone dans le sang) pour réguler l'activité des pics de GnRH.
Activité
L'activité de la GnRH est très faible chez l'enfant. Elle apparait au moment de la puberté pour installer le développement des fonctions reproductives.
Quoique synthétisée en continu, elle est sécrétée de façon pulsatile (avec une décharge toutes les soixante à quatre-vingt-dix minutes). Chez la femme, sa sécrétion varie aussi de manière cyclique, avec un pic qui entraînera l'ovulation. Lors d'une grossesse, la synthèse et la sécrétion de GnRH s'arrête, de même qu'en période d'allaitement (par un rétro-contrôle négatif de la prolactine). La dopamine diminue également l'activité de la GnRH.
En physiopathologie, l'activité de la GnRH peut être perturbée dans le cas de maladie de l'axe hypothalamo-hypophysaire-gonade (traumatisme, tumeurs...). Il existe également une pathologie héréditaire qui aboutit à l'absence de sécrétion de GnRH, le syndrome de Kallmann, caractérisé par une absence de développement pubertaire. Ainsi par suite d'une série de mauvaises interprétations et notamment d'une inversion de dossier (homonymes), des analogues GnRH ont été prescrits à un patient de Madrid. Au bout de quelques semaines, ce patient de 47 ans voit sa production de sperme augmenter sensiblement, mais également une augmentation du volume des testicules. Une odeur de transpiration plus forte est également notée par ce patient. Une hospitalisation et des examens ont permis de mettre en corrélation ce traitement avec les transformations constatées. (Source : Faculté de médicina - Hospital général de Galicia)[source insuffisante]
GnRH dans d'autres organes
Il y a des sécrétions ectopiques de GnRH par d'autres tissus que l'hypothalamus au niveau du placenta et des gonades. Leurs rôles sont actuellement peu connus.
Agonistes et antagonistes
La GnRH synthétique est actuellement synthétisable et commercialisée, mais sa demi-vie requiert l'utilisation de pompe à infusion pour des utilisations cliniques. Des analogues de la GnRH sont utilisés pour des traitements endocriniens qui visent à stimuler (agonistes) ou réprimer (antagonistes) les sécrétions d'hormones hypophysaires en cas de désordre endocrinien.
Les principaux agonistes sont la leuproréline, goséréline et la triptoréline.
La leuproréline est un nonapeptide de synthèse analogue de la GnRH naturelle. Utile dans le traitement de l'endométriose ou de certains cancers de la prostate; administrée par voie injectable. Les études conduites chez l'homme comme chez l'animal ont montré qu'après une stimulation initiale, l'administration prolongée de leuproréline entraîne une diminution de la sécrétion gonadotrope, supprimant les fonctions testiculaires chez l'homme ou entraînant une atrophie du tissu endométrial utérin et ectopique chez la femme. Cet effet est réversible à l'arrêt du traitement.
Une diminution de la sensibilité des récepteurs périphériques à la GnRH a été également évoquée à la suite de certaines études animales. Il s'agit d'un effet direct par diminution de la sensibilité des récepteurs périphériques à la GnRH.
Chez l'homme, après administration de la première dose, il se produit une élévation des taux sanguins de LH et FSH entraînant une augmentation initiale des taux de stéroïdes gonadiques (testostérone et dihydrotestostérone).
La poursuite du traitement entraîne une diminution des taux de LH et FSH conduisant, dans un délai de 4 semaines à une diminution des taux de testostérone qui deviennent équivalents à ceux observés après castration chirurgicale ; cet effet persiste aussi longtemps que le produit est administré.
Chez la femme, l'administration prolongée de leuproréline entraîne une suppression de la sécrétion d'estradiol et ainsi une mise au repos du tissu endométriosique.
Dans le cadre du traitement de l'endométriose par leuproréline combiné à une hormonothérapie de substitution (« add-back therapy »), des données cliniques sur une période thérapeutique de un an ont été obtenues avec le schéma posologique comportant du valérate d'oestradiol micronisé 2 mg par jour administré par voie orale et de la promégestone 0.5 mg par jour administrée par voie orale.
Chez l'enfant, l'inhibition de l'hyperactivité gonadotrope hypophysaire se manifeste, dans les deux sexes, par la suppression de la sécrétion d'estradiol ou de testostérone, par l'abaissement du pic de LH et par une amélioration du rapport âge statural/âge osseux. La stimulation gonadique initiale peut être responsable de petites hémorragies génitales.
L'elagolix est un inhibiteur de la GnRH, donné par voie orale.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Geneviève Durand, Jean-Louis Beaudeux, Biochimie médicale, Lavoisier, , p. 29.
- (en) Penny Williamson, Jill Lang et Yvonne Boyd, « The gonadotropin-releasing hormone (Gnrh) gene maps to mouse chromosome 14 and identifies a homologous region on human chromosome 8 », Somatic Cell and Molecular Genetics, vol. 17, , p. 609–615 (ISSN 0740-7750 et 1572-9931, DOI 10.1007/BF01233626, lire en ligne, consulté le ).
Voir aussi
- Portail de la biochimie
- Portail de la chimie
- Portail de la physiologie
- Portail de la médecine