Méthénamine
La méthénamine, hexamine, urotropine, ou hexaméthylènetétramine, est un composé organique hétérocyclique possédant une structure cage de type adamantane. Il fut découvert en 1859 par le chimiste russe Alexandre Boutlerov.
| Méthénamine | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 1,3,5,7-tétraazatricyclo[3.3.1.13,7]décane | ||
| Synonymes |
hexamine, urotropine, hexaméthylènetétramine |
||
| No CAS | |||
| No ECHA | 100.002.642 | ||
| No CE | 202-905-8 | ||
| Code ATC | J01 | ||
| PubChem | 4101 | ||
| No E | E239 | ||
| SMILES | |||
| InChI | |||
| Apparence | cristaux hygroscopiques et incolores ou poudre cristalline blanche[1] | ||
| Propriétés chimiques | |||
| Formule | C6H12N4 [Isomères] |
||
| Masse molaire[2] | 140,1863 ± 0,0064 g/mol C 51,41 %, H 8,63 %, N 39,97 %, |
||
| Propriétés physiques | |||
| T° fusion | >263 °C décomposition en formaldéhyde, NOx, ammoniac | ||
| T° ébullition | Point de sublimation : environ 260 °C[1] | ||
| Solubilité | Eau : 853 g·l-1 à 25 °C Chloroforme : 13,4 % à 20 °C Éthanol : 2,89 % à 20 °C Acétone : 0,65 % à 20 °C Éther : 0,06 % à 20 °C Méthanol : 7,25 % à 20 °C |
||
| Masse volumique | 1,33 g·cm-3[1] | ||
| T° d'auto-inflammation | 390 °C[1] | ||
| Point d’éclair | 250 °C (coupelle fermée)[1] | ||
| Pression de vapeur saturante | ≈0,0005 mbar à 20 °C ≈0,0015 mbar à 30 °C ≈0,009 mbar à 50 °C |
||
| Précautions | |||
| SGH[3] | |||
  Danger |
|||
| SIMDUT[4] | |||
 B4, |
|||
| Transport | |||
| Écotoxicologie | |||
| DL50 | 569 mg·kg-1 (souris, oral) 17,7 ml·kg-1 (souris, i.v.) 215 mg·kg-1 (souris, s.c.) |
||
| LogP | -2,84[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Ce composé est utilisé dans des applications diverses et variées, par exemple comme antiseptique pour le traitement des infections urinaires, dans la fabrication de résines, ou comme réactif organique.
Généralités
Structure
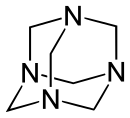
La méthénamine (CH2)6N4 possède quatre atomes d'azote reliés entre eux par des groupements méthylène. Cette molécule présente donc une structure cage, symétrique, similaire à celle de l'adamantane. Malgré sa forme moléculaire, la méthénamine n'est pas capable d'encapsuler d'autres atomes ou molécules car l'espace vide à l'intérieur de celle-ci n'est pas suffisant à la création de liaisons.
Synthèse
La méthénamine est obtenue par une réaction de condensation entre le formaldéhyde et l'ammoniac. Cette réaction peut être réalisée en phase gaz ou en solution.

Propriétés
La méthénamine se présente sous la forme d'une poudre blanche ou de cristaux incolores hygroscopiques.
Elle est très soluble dans l'eau, soluble dans les solvants organiques polaires tels que le méthanol et l'éthanol, peu soluble dans l'éther éthylique et insoluble dans l'éther de pétrole.
À température élevée (200 à 300 °C), la méthénamine se décompose principalement en ammoniac et en formaldéhyde.
Les solutions aqueuses de méthénamine sont faiblement basiques (une solution à 0,2 M en HMTA a un pH de 8,4). En milieu acide, elle s'hydrolyse en libérant ammoniac et formaldéhyde[5].
Applications
| méthénamine | |
| Noms commerciaux |
|
|---|---|
| Laboratoire | Erfa Canada 2012 Inc, Graceway, Iromedica, Lafran, Medgenix |
| Forme | comprimés dosés à 50 mg, à 100 mg pour 5 g, à 1 g |
| Administration | per os ; pommade pour applications cutanées |
| Classe |
|
| Identification | |
| No CAS | |
| No ECHA | 100.002.642 |
| Code ATC | J01XX05 |
| DrugBank | 06799 |
Domaine médical
De par certaines de ses caractéristiques, la méthénamine est utilisée comme antiseptique dans le traitement des infections des voies urinaires basses. L'urine étant acide, la molécule, relativement peu toxique, se décompose en formaldéhyde et ammoniac. Le formaldéhyde possède des propriétés bactéricides et va donc combattre l'infection.
La méthénamine se présente sous la forme d'un comprimé gastro-résistant nécessaire pour contourner l'acidité gastrique et n'agir que dans les voies urinaires. Malgré cette forme d'administration, ce médicament reste relativement peu coûteux.
De plus, il est particulièrement adapté à long terme car les bactéries ne développent pas de résistance au formaldéhyde.
Colorant histologique
Les colorants argentiques de la méthénamine sont employés pour la coloration en histologie, incluant les méthodes suivantes :
- la coloration argentique de Grocott, largement employée pour la visualisation des organismes fongiques ;
- la coloration argentique de Jones, un acide periodique de Schiff, combiné à de l'argent et à de la méthénamine, permettant de voir l'aspect « piqueté » des membranes basales glomérulaires des glomérulonéphrites extramembraneuses, pour le diagnostic de cette maladie auto-immune.
Résine
La méthénamine sert également dans la préparation des résines phénoliques. Elle peut être utilisée comme agent réticulant de par la formation de formaldéhyde qui va permettre d'assembler les phénols entre eux.
La méthénamine est aussi utilisée comme catalyseur et permet le contrôle de la porosité au sein de la résine.
Combustible solide
L'hexaméthylènetétramine est aussi le principal composé de certaines pastilles de combustible. Ces pastilles sont utilisées par les campeurs, des laboratoires de recherches pour standardiser les sources de feu (essais d'inflammabilité) ou les militaires pour le réchauffage des aliments dans certaines rations alimentaires de l'armée française.
Elles brûlent sans dégagement de fumée, ne se liquéfient pas en brûlant et ne produisent pas de cendres. La densité énergétique est importante (30,0 MJ/kg). Cependant, la chaleur produite par ces pastilles est difficile à contrôler et les vapeurs qui s'en échappent sont nocives.
Additif alimentaire
L'hexaméthylènetétramine est aussi employée comme additif alimentaire en tant que conservateur, sous le code E239. Autorisée à l'usage dans ce but dans l'Union européenne, elle n'est cependant pas approuvée aux États-Unis, ainsi qu'en Russie, l'Australie ou la Nouvelle-Zélande.
Chimie organique
L'hexaméthylènetétramine est un réactif en synthèse organique utilisé dans plusieurs réactions chimiques notamment la réaction de Duff (formylation aromatique), la réaction de Sommelet (transformation des halogénures benzyliques en aldéhydes) ou dans la réaction de Delépine (en) (synthèse d'amines à partir d'halogénures d'alkyles).
Explosifs
L'hexaméthylènetétramine est le composant de base dans la production du RDX (hexogène) et en conséquence du C-4, ainsi que de l'octogène, le dinitrate d'hexamine (HDN), le triperoxyde d'hexaméthylène diamine (HMTD), etc.
Autres applications
L'hexaméthylènetétramine est également utilisée comme inhibiteur de corrosion dans l'industrie des métaux, conservateur dans l'industrie des peintures, comme fongicide et a une utilité dans le domaine des cosmétiques, de l'industrie alimentaire, etc.
Notes et références
- HEXAMETHYLENETETRAMINE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Hexaméthylènetétramine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Substance Display 7847459, NCBI database
Voir aussi
Articles connexes
Liens externes
- (en) Substance Display 7847459, NCBI database
- (en) Drug: D00393, sur www.genome.net
- Page spécifique dans la base de données sur les produits pharmaceutiques (Canada)
- Compendium suisse des médicaments : spécialités contenant Méthénamine
- Page spécifique sur le Répertoire Commenté des Médicaments, par le Centre belge d'information pharmacothérapeutique
- (de) Page spécifique dans la base de données sur les produits vétérinaires (Veterinärprodukte, Futtermittel & Zusatzstoffe, Suisse)
- (en) Spectre IR et spectre de masse, NIST
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie