Décacarbonyle de dimanganèse
Le décacarbonyle de dimanganèse est un carbonyle de métal de formule chimique Mn2(CO)10. Cet agrégat atomique présente une géométrie du groupe de symétrie assez rare D4d[3] car il ne contient pas de ligand pontant : tous les groupes carbonyle sont liés chacun à un atome de manganèse, la liaison Mn–Mn ayant une longueur de 293 pm.
| Décacarbonyle de dimanganèse | |||
10.png.webp) 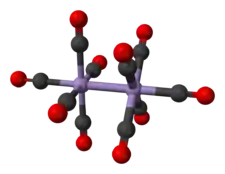 Structure du décacarbonyle de dimanganèse |
|||
| Identification | |||
|---|---|---|---|
| Synonymes |
carbonyle de manganèse, |
||
| No CAS | |||
| No ECHA | 100.030.392 | ||
| No CE | 233-445-6 | ||
| PubChem | 517769 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide cristallisé de couleur jaune | ||
| Propriétés chimiques | |||
| Formule | C10Mn2O10 |
||
| Masse molaire[1] | 389,9771 ± 0,011 g/mol C 30,8 %, Mn 28,18 %, O 41,03 %, |
||
| Propriétés physiques | |||
| T° fusion | 154 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
 Danger |
|||
| Transport[2] | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le Mn2(CO)10 se présente sous la forme d'un solide cristallisé de couleur jaune qui fond vers 154 °C. C'est un réactif important de la chimie des composés organométalliques du manganèse. Il a d'abord été préparé, avec un faible rendement, par réduction de l'iodure de manganèse(II) MnI2 par le magnésium Mg dans le monoxyde de carbone CO. Un mode de production plus efficace fait intervenir la réduction du chlorure de manganèse(II) MnCl2 anhydre par le cétyle sodium/benzophénone sous 200 atm de CO. Enfin, la disponibilité de grandes quantités de méthylcyclopentadiényle tricarbonyle de manganèse bon marché a permis de développer des procédés basse pression pour produire le Mn2(CO)10.
Le décacarbonyle de dimanganèse est stable à l'air mais ses solutions requièrent des rampes à vide. Il offre quelques utilisations intéressantes en synthèse organique. Ainsi, la réduction du Mn2(CO)10 donne l'anion pentacarbonyle de manganèse [Mn(CO)5]–, qui peut être isolé sous forme de sel :
- Mn2(CO)10 + 2 Na → 2 Na[Mn(CO)5].
Cet anion est un nucléophile polyvalent. Sa protonation donne l'hydrure HMn(CO)5, tandis que sa méthylation conduit au (CH3)Mn(CO)5.
Par ailleurs, l'halogénation de Mn2(CO)10 brise la liaison Mn–Mn, par exemple avec le dibrome Br2 :
- Mn2(CO)10 + Br2 → 2 Mn(CO)5Br.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Manganese(0) carbonyl 98%, consultée le 10 mai 2013.
- (en) Lawrence F. Dahl, Etsuro Ishishi et R. E. Rundle, « Polynuclear Metal Carbonyls. I. Structures of Mn2(CO)10 and Re2(CO)10 », Journal of Chemical Physics, vol. 26, no 6, , p. 1750-1751 (lire en ligne) DOI:10.1063/1.1743615
- Portail de la chimie
