Biologie quantique
La biologie quantique est l'étude des applications de la mécanique quantique et de la chimie théorique aux objets et problèmes biologiques. De nombreux processus biologiques impliquent la conversion de l'énergie en des formes utilisables pour des transformations chimiques et sont de nature quantique. Ces processus impliquent des réactions chimiques, l'absorption de la lumière, la formation d'états électroniques excités, le transfert d'énergie d'excitation et le transfert d'électrons et de protons (ions hydrogène) dans des processus chimiques tels que la photosynthèse, l'olfaction et la respiration cellulaire[1].
La biologie quantique peut utiliser des calculs pour modéliser les interactions biologiques à la lumière des effets de la mécanique quantique[2]. La biologie quantique s'intéresse à l'influence des phénomènes quantiques non triviaux[3], qui peuvent s'expliquer en réduisant le processus biologique à la physique fondamentale, bien que ces effets soient difficiles à étudier et puissent être spéculatifs[4].
Histoire
La biologie quantique est un domaine émergent ; la plupart des recherches actuelles sont théoriques et sujettes à des questions qui nécessitent des expérimentations supplémentaires pour pouvoir y répondre en se basant sur des preuves expérimentales. Bien que ce domaine n'ait reçu que récemment un afflux d'attention, il a été conceptualisé par les physiciens tout au long du XXe siècle. La biologie quantique a été considérée comme pouvant jouer un rôle essentiel dans l'avenir du monde médical[5]. Les premiers pionniers de la physique quantique ont vu des applications de la mécanique quantique dans les problèmes biologiques. Le livre d'Erwin Schrödinger, What is Life ?, publié en 1944, traite des applications de la mécanique quantique en biologie[6]. Schrödinger a introduit l'idée d'un "cristal apériodique" qui contient des informations génétiques dans sa configuration de liaisons chimiques covalentes. Il a en outre suggéré que les mutations sont introduites par des "sauts quantiques". D'autres pionniers comme Niels Bohr, Pascual Jordan et Max Delbrück ont soutenu que l'idée quantique de complémentarité était fondamentale en sciences de la vie[7]. En 1963, Per-Olov Löwdin a publié l'effet tunnel des protons décrit comme étant un autre mécanisme de mutation de l'ADN. Dans son article, il a déclaré qu'il existe un nouveau domaine d'étude appelé "biologie quantique"[8].
Applications
| Phénomène biologique | Effet quantique |
|---|---|
| Vision, bioluminescence, odorat photorécepteurs, synthèse de la vitamine D | États électroniques excités |
| Activités enzymatiques, notamment impliquées dans la respiration cellulaire et la photosynthèse | Effet tunnel de l'électron |
| Magnétoréception | Spin de l'électron, paires de radicaux intriquées |
| Utilisation des photons dans la photosynthèse | Transfer d'énergie de l'électron impliquant la cohérence quantique |
Photosynthèse
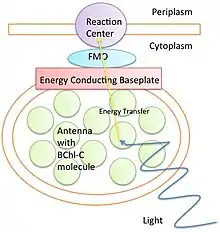
Les organismes qui subissent la photosynthèse absorbent l'énergie lumineuse par le processus d'excitation des électrons dans des structures appelées « antennes ». Ces antennes varient selon les organismes. Par exemple, les bactéries (cyanobactéries) utilisent des antennes en forme d'anneau, tandis que chez les plantes ce sont les pigments de chlorophylle qui absorbent les photons. La photosynthèse crée des excitons, qui fournissent une séparation de charge que les cellules convertissent en énergie chimique utilisable. L'énergie collectée dans les sites de réaction doit être transférée rapidement avant d'être perdue par fluorescence ou par mouvement vibratoire thermique.
Diverses structures, telles que le complexe FMO des bactéries vertes sulfureuses, sont responsables du transfert de l'énergie des antennes vers un site de réaction. Les études en spectroscopie électronique FT sur l'absorption et le transfert d'électrons montrent une efficacité supérieure à 99 %[9], qui ne peut être expliquée par les modèles mécaniques classiques comme le modèle de diffusion. On les a donc remis en question et dès 1938, les scientifiques ont théorisé que la cohérence quantique était le mécanisme du transfert d'énergie d'excitation.
Les scientifiques ont récemment cherché des preuves expérimentales de ce mécanisme proposé de transfert d'énergie. Une étude publiée en 2007 a revendiqué l'identification de la cohérence quantique électronique[10] à -196 °C (77 K). Une autre étude théorique datant de 2010 a fourni la preuve que la cohérence quantique vit jusqu'à 300 femtosecondes (300-15 s) à des températures biologiquement pertinentes (4 °C ou 277 K) . La même année, des expériences menées sur des algues cryptophytes photosynthétiques en spectroscopie d'écho de photons en deux dimensions ont confirmé la cohérence quantique à long terme[11]. Ces études suggèrent qu'au cours de l'évolution, la nature a développé un moyen de protéger la cohérence quantique pour améliorer l'efficacité de la photosynthèse. Cependant, des études de suivi critiques remettent en question l'interprétation de ces résultats. La spectroscopie à molécule unique montre aujourd'hui les caractéristiques quantiques de la photosynthèse sans l'interférence d'un désordre statique, et certaines études utilisent cette méthode pour attribuer les signatures rapportées de la cohérence quantique électronique à la dynamique nucléaire se produisant dans les chromophores[12],[13],[14],[15],[16],[17],[18]. Un certain nombre de propositions ont émergé pour tenter d'expliquer cette cohérence inattendue sur le long terme inattendue. Selon une proposition, si chaque site du complexe "ressent" son propre bruit environnemental, l'électron ne restera pas dans un minimum local en raison à la fois de la cohérence quantique et de l'environnement thermique, mais se dirigera vers le site de réaction par des "marches quantiques"[19],[20],[21]. Une autre proposition est que le taux de cohérence quantique et l'effet tunnel des électrons créent un puits d'énergie qui déplace rapidement l'électron vers le site de réaction[22]. D'autres travaux ont suggéré que les symétries géométriques dans le complexe pourraient favoriser un transfert d'énergie efficace vers le centre de réaction, reflétant un transfert d'état parfait dans les réseaux quantiques[22]. En outre, les expériences avec des molécules de colorants artificiels jettent des doutes sur l'interprétation selon laquelle les effets quantiques ne durent pas plus de cent femtosecondes[23].
En 2017, la première expérience de contrôle avec la protéine FMO originale en conditions ambiantes a confirmé que les effets quantiques électroniques sont éliminés en 60 femtosecondes, alors que le transfert global d'exciton prend un temps de l'ordre de quelques picosecondes (10-12 s)[24]. En 2020, une revue de la littérature basée sur une vaste gamme d'expériences de contrôle et de théories a conclu que les effets quantiques proposés ne tenaient pas, en raison de la longue durée de vie des cohérences électroniques dans le système FMO[25]. Les recherches sur la dynamique du transport suggèrent plutôt que les interactions entre les modes d'excitation électronique et vibratoire dans les complexes FMO nécessitent une explication semi-classique, semi-quantique du transfert de l'énergie d'excitation. En d'autres termes, alors que la cohérence quantique domine à court terme, une description classique est plus précise pour décrire le comportement à long terme des excitons[26].
Un autre processus de la photosynthèse qui a une efficacité de presque 100% est le transfert de charge, ce qui suggère à nouveau que des phénomènes de mécanique quantique sont en jeu[18]. En 1966, une étude sur la bactérie photosynthétique Chromatium a montré qu'à des températures inférieures à 100 K, l'oxydation du cytochrome est indépendante de la température, lente (de l'ordre de la milliseconde) et très faible en énergie d'activation. Les auteurs, Don DeVault et Britton Chase, ont postulé que ces caractéristiques du transfert d'électrons sont indicatives d'un effet tunnel quantique, selon lequel les électrons pénètrent une barrière potentielle bien qu'ils possèdent moins d'énergie que ce qui est classiquement nécessaire[27].
Mutations de l'ADN
L'acide désoxyribonucléique, l'ADN, sert d'instruction pour la fabrication de protéines dans tout l'organisme. Il est constitué de 4 nucléotides : guanine, thymine, cytosine et adénine[28]. Le nombre et l'ordre dans lequel sont agencés ces nucléotides donne les "recettes" pour fabriquer les différentes protéines.
Chaque fois qu'une cellule se reproduit, elle doit copier ces brins d'ADN. Cependant, il arrive parfois qu'une mutation ou une erreur dans le code de l'ADN se produise tout au long du processus de copie du brin d'ADN. Le modèle de mutation de l'ADN de Lowdin explique une théorie du raisonnement qui sous-tend la mutation de l'ADN[29]. Dans ce modèle, un nucléotide peut changer de forme par un processus d'effet tunnel quantique. De ce fait, le nucléotide modifié perdra sa capacité à s'apparier avec sa paire de bases d'origine et modifiera par conséquent la structure et l'ordre du brin d'ADN.
L'exposition aux rayons ultraviolets et à d'autres types de rayonnement peut provoquer une mutation et des dommages de l'ADN. Les radiations peuvent également modifier les liaisons des pyrimidines le long du brin d'ADN et les faire se lier à elles-mêmes pour créer un dimère[30].
Chez de nombreux procaryotes et plantes, ces liaisons sont réparées et les molécules retrouvent leur forme originale grâce à une enzyme de réparation de l'ADN, la photolyase. Comme son préfixe l'indique, la photolyase dépend de la lumière pour réparer le brin. La photolyase travaille avec son cofacteur FADH, le dinucléotide adénine flavinique, tout en réparant l'ADN. La photolyase est excitée par la lumière visible et transfère un électron au cofacteur FADH. Le FADH, maintenant en possession d'un électron supplémentaire, donne cet électron au dimère pour briser la liaison et réparer l'ADN. Ce transfert de l'électron se fait par effet tunnel entre l'électron du FADH et le dimère. Bien que la portée de l'effet tunnel soit beaucoup plus grande que ce qui est possible dans le vide, on dit que l'effet tunnel dans ce scénario est un "effet tunnel à super échange", et qu'il est possible grâce à la capacité de la protéine à augmenter le taux d'effet tunnel de l'électron[29].
Aspects quantiques de l'ADN
Du début des années 1960[31] à nos jours (2020), une biologie quantique s'est construite, en montrant peu à peu que l'ADN et divers organismes vivants ont au cours de l'évolution ont « appris » à exploiter certaines propriétés de la physique quantique[32].
Historiquement, Schrödinger a influencé à la fois James Watson et Francis Crick qui ont découvert la double hélice d'ADN ; il les a encouragé à étudier la nature des gènes. Schrödinger a selon Watson élégamment expliqué qu'il fallait comprendre comment les gènes agissent pour comprendre la vie [33].
Ensuite le succès de la biologie moléculaire (clonage de gènes, génie génétique, OGM, empreinte du génome, séquençage) a éclipsé et fait oublier les phénomènes quantiques potentiellement en jeu.
Les généticiens et le monde des biotechnologies ont à cette époque d'abord évité d'intégrer les aspects quantique de la physique et de la chimie dans leurs modèles du monde (aspects qui ne leur étaient pas nécessaires, et mathématiquement et intellectuellement, contre-intuitifs et donc plus difficile d'accès). Les biochimistes s'étonnaient simplement de l'extrême rapidité et efficacité de certains phénomènes (enzymatiques, photosynthétiques), sans pouvoir l'expliquer.
Les physiciens, de leur côté, ont longtemps cru qu'il était impossible que des effets quantiques puissent être mobilisés par les organismes vivants tels que bactéries, plantes, champignons ou animaux. Leur principal argument était que les physiciens devaient eux-mêmes, pour démontrer l'existence de phénomènes quantiques dans les systèmes physiques inorganiques, travailler dans un environnement extrêmement contrôlé, et notamment à des températures proches du zéro absolu, dans le vide et justement à l'abri de l'environnement, source continuelle d'interférences. Ils pensaient alors que des phénomènes de nature quantiques (ex : effet tunnel, effets d'interférence quantique) ne pouvaient s'exprimer que dans un sous-système cohérent et très isolé de son environnement. Beaucoup de physiciens se sont d'abord moqué des biologistes qui ont posé l'hypothèse que la mécanique quantique était peut-être utilisée par le vivant dans les conditions habituelles de température et de pression, et au sein d'un milieu aussi complexe que la cellule.
Un premier indice avait pourtant été suggéré par Watson et Crick. Ces derniers avaient en effet suggéré que les mutations génétiques puissent être crées dans la double hélice par la tautomérisation des bases d'ADN, transformant des formes imino- communes en formes énol rares, produisant ainsi des paires de bases incorrectement accouplée lors de la réplication de l'ADN.
Une « traduction quantique » de cette idée a été suggérée dès 1963 par Per-Olov Löwdin ; ce physicien suédois, a proposé[31] que des tunnels protoniques puissent générer les bases tautomères. Per-Olov Löwdin apporte ainsi un mécanisme explicatif physique à la spéculation de Schrödinger selon laquelle les mutations ponctuelles aléatoires pourraient avoir une origine quantique ; en effet, tout code génétique (paires de bases d'un brin d'ADN) est maintenu en double hélice par un arrangement unique de liaisons hydrogène. Un atome d'hydrogène perdant un simple électron devient un proton et il semble possible que lors de la réplication d'un brin d'ADN, il y ait une probabilité qu'un tunnel protonique se produise en changeant la configuration de la liaison hydrogène, ce qui altère légèrement le code génétique[31]. Une telle « tunnellisation » protonique pourrait aussi expliquer le vieillissement et l'apparition du dysfonctionnement cellulaires aboutissant aux tumeurs et cancers.
Dans les années 1960, peu de généticiens connaissaient cependant les apports de Löwdin, faisant que les biologistes, biophysiciens et biochimistes ont d'abord pensé que la mécanique quantique ne pouvait pas jouer de rôle spécifique dans les systèmes vivants. A titre d'exemple, en 1962, le chimiste théoricien britannique Christopher Longuet-Higgins (qui à l'Université de Cambridge, a beaucoup apporté à la chimie moléculaire via la modélisation et l'analyse mathématiques) dans un texte (exposé fait lors d'une conférence) intitulé « Quantum Mechanics and Biology »[34] s'oppose à l'idée que la mécanique quantique joue un jeu en biologie, tout en reconnaissant que la physique classique peine à expliquer trois phénomènes : la photosynthèse, la sensibilité rétinienne et la bio-luminescence. Il argue que la cartographie du cycle de Krebs et du cycle de Calvin, deux cycles complexes et fondamentaux pour le vivant n'a pas nécessité de connaissances en mécanique quantique autres que celles qui sont familières au pur chimiste organique s'intéressant aux mécanismes de réaction biochimiques.
Parmi les premiers, Ludwig von Bertalanffy a estimé que les lois déterministes classiques de la physique-chimie ne permettent pas de rendre compte de tous les phénomènes de la vie[35].
Des physiciens de la mécanique quantique (Bohr dans la revue Nature en 1933)[36], Schrödinger, en 1944 dans son livre Qu'est-ce que la Vie ?[37] et Jordan dans un article de 1932 sur la mécanique quantique et les problèmes de base de la biologie et de la psychologie[38] notamment) ont ensuite suggéré que la physique quantique pourrait combler ces lacunes explicatives, sans encore trop savoir comment. Mobilisant les notions de complémentarité et de principe d'incertitude, ils ont estimé que la mesure et l'aléatoire quantique auraient même pu jouer un rôle important dans l'évolution, voire fournir un contrôle directionnel au processus évolutif. Ce dernier point de vue est aujourd'hui discrédité (presque tous les biologistes estiment qu'il n'y aucun indice de directionnalité dans le moteur de l'évolution que constitue le jeu des mutations). De même le point de vue d'Eugène Wigner sur la conscience comme ingrédient magique à la résolution du problème de mesure[39] est aussi maintenant largement discrédité.
Théorie vibratoire de l'olfaction
L'olfaction, le sens de l'odorat, peut être décomposée en deux parties : la réception et la détection d'un produit chimique, puis la façon dont cette détection est envoyée au cerveau et traitée par celui-ci. Ce processus de détection d'une substance odorante est toujours remis en question à l'heure actuelle. Une théorie appelée "théorie de la forme de l'olfaction" suggère que certains récepteurs olfactifs sont déclenchés par certaines formes de produits chimiques et que ces récepteurs envoient un message spécifique au cerveau[40]. Une autre théorie (basée sur des phénomènes quantiques) suggère que les récepteurs olfactifs détectent la vibration des molécules qui les atteignent et que « l'odeur » est due à différentes fréquences vibratoires ; cette théorie est appelée à juste titre « théorie vibratoire de l'olfaction ».
La théorie vibratoire de l'olfaction, créée en 1938 par Malcolm Dyson[41] mais revigorée par Luca Turin en 1996[42], propose que le mécanisme de l'odorat est dû aux récepteurs de la protéine G qui détectent les vibrations moléculaires dues à l'effet tunnel inélastique des électrons (effet tunnel où l'électron perd de l'énergie) à travers les molécules[42]. Après la liaison du produit chimique au récepteur, le produit chimique agirait alors comme un pont permettant le transfert de l'électron à travers la protéine. Au fur et à mesure du transfert de l'électron, ce pont serait généralement une barrière pour les électrons et perdrait son énergie en raison de la vibration de la molécule récemment liée au récepteur, ce qui permettrait de sentir la molécule[42],[3].
Bien que la théorie vibratoire ait fait l'objet d'une certaine preuve expérimentale de son concept[43],[44], les expériences ont donné lieu à de multiples résultats controversés. Dans certaines expériences, les animaux sont capables de distinguer les odeurs entre des molécules de fréquences différentes et de même structure[45] ; d'autres expériences montrent que les personnes ne sont pas conscientes de distinguer les odeurs en raison de fréquences moléculaires distinctes[46]. Cependant, cela n'a pas été réfuté, et il a même été démontré que cela avait un effet sur l'olfaction d'animaux autres que les humains, comme les mouches, les abeilles et les poissons.
Vision
La vision repose sur une énergie quantifiée afin de convertir les signaux lumineux en un potentiel d'action dans un processus appelé phototransduction. Dans la phototransduction, un photon interagit avec un chromophore dans un récepteur de lumière. Le chromophore absorbe le photon et subit une photoisomérisation. Ce changement de structure induit une modification de la structure du photorécepteur et les voies de transduction du signal qui en résultent conduisent à un signal visuel. Cependant, la réaction de photoisomérisation se produit à un rythme rapide, en moins de 200 femtosecondes[47], avec un rendement élevé. Les modèles suggèrent l'utilisation d'effets quantiques dans la mise en forme de l'état de base et des potentiels d'état excité afin d'atteindre cette efficacité[48].
Applications de la vision quantique
Des expériences ont montré que les capteurs de la rétine de l'œil humain sont suffisamment sensibles pour détecter un seul photon[49]. La détection d'un seul photon pourrait conduire à de multiples technologies différentes. Un domaine de développement est la communication et la cryptographie quantiques. L'idée est d'utiliser un système biométrique pour mesurer l'œil en utilisant seulement un petit nombre de points sur la rétine avec des flashs aléatoires de photons qui "lisent" la rétine et identifient l'individu[50]. Ce système biométrique permettrait seulement à un certain individu avec une carte rétinienne spécifique de décoder le message. Ce message ne pourrait être décodé par personne d'autre, à moins que l'espion ne devine la bonne carte ou ne puisse lire la rétine du destinataire du message[51].
Activité enzymatique (biochimie quantique)
Les enzymes peuvent utiliser l'effet tunnel quantique pour transférer des électrons sur de longues distances. Il est possible que la conformation quaternaire des protéines ait évolué pour permettre un enchevêtrement et une cohérence quantiques soutenus[52]. Plus précisément, les enzymes peuvent augmenter le pourcentage de la réaction qui se produit par "tunnelisation" de l'hydrogène[53]. La tunnelisation fait référence à la capacité d'une petite particule de masse à traverser les barrières énergétiques. Cette capacité est due au principe de complémentarité, selon lequel certains objets ont des paires de propriétés qui ne peuvent être mesurées séparément sans modifier le résultat de la mesure. Les électrons ont à la fois des propriétés d'onde et de particule, ils peuvent donc traverser les barrières physiques comme une onde sans enfreindre les lois de la physique. Des études montrent que les transferts d'électrons à longue distance entre centres redox par effet tunnel quantique jouent un rôle important dans l'activité enzymatique de la photosynthèse et de la respiration cellulaire[54],[53]. Par exemple, des études montrent que l'effet tunnel des électrons à longue distance de l'ordre de 15-30 Å (10-10 m) joue un rôle dans les réactions redox des enzymes de la respiration cellulaire[55]. Sans effet tunnel quantique, les organismes ne seraient pas capables de convertir l'énergie assez rapidement pour soutenir leur croissance. Même s'il existe de telles séparations entre les sites d'oxydoréduction au sein des enzymes, les électrons sont transférés avec succès, généralement indépendamment de la température (sauf dans des conditions extrêmes) et de la distance[53], ce qui suggère la capacité des électrons à "creuser des tunnels" dans des conditions physiologiques. Des recherches supplémentaires sont nécessaires pour déterminer si ce phénomène spécifique d'effet tunnel est également cohérent.
Magnétoréception
La magnétoréception désigne la capacité des animaux à se déplacer en utilisant l'inclinaison du champ magnétique terrestre[56]. Une explication possible de la magnétoréception est le mécanisme de paires de radicaux enchevêtrés[57],[58]. Le mécanisme de paires de radicaux est bien établi dans la chimie du spin[59],[60],[61] et a été supposé s'appliquer à la magnétoréception en 1978 par Schulten et al. Le rapport entre les paires de singulets et de triplets est modifié par l'interaction des paires d'électrons enchevêtrées avec le champ magnétique terrestre[62]. En 2000, le cryptochrome a été proposé comme "molécule magnétique" pouvant abriter des paires de radicaux magnétiquement sensibles. Le cryptochrome, une flavoprotéine présente dans les yeux des rouges-gorges européens et d'autres espèces animales, est la seule protéine connue pour former des paires de radicaux photo-induits chez les animaux[56]. Lorsqu'il interagit avec des particules de lumière, le cryptochrome passe par une réaction d'oxydoréduction, qui produit des paires de radicaux à la fois pendant la photo-réduction et l'oxydation. La fonction du cryptochrome varie d'une espèce à l'autre, mais la photoinduction de paires de radicaux se produit par exposition à la lumière bleue, qui excite un électron dans un chromophore[62]. La magnétoréception est également possible dans l'obscurité, le mécanisme doit donc reposer davantage sur les paires de radicaux générées pendant l'oxydation indépendante de la lumière.
Les expériences menées en laboratoire confirment la théorie de base selon laquelle les électrons des paires de radicaux peuvent être influencés de manière significative par des champs magnétiques très faibles, c'est-à-dire que seule la direction des champs magnétiques faibles peut affecter la réactivité des paires de radicaux et donc "catalyser" la formation de produits chimiques. On ne sait pas si ce mécanisme s'applique à la magnétoréception et/ou à la biologie quantique, c'est-à-dire si le champ magnétique terrestre "catalyse" la formation de produits biochimiques à l'aide de paires de radicaux, pour deux raisons. La première est qu'il n'est pas nécessaire que les paires de radicaux soient enchevêtrées, la caractéristique quantique clé du mécanisme des paires de radicaux, pour jouer un rôle dans ces processus. Il existe des paires radicales enchevêtrées et non enchevêtrées. Cependant, les chercheurs ont trouvé des preuves du mécanisme de magnétoréception des paires de radicaux lorsque les rouges-gorges, les cafards et les fauvettes de jardin européens ne pouvaient plus naviguer lorsqu'ils étaient exposés à une fréquence radio qui bloque les champs magnétiques[56] et la chimie des paires de radicaux. Pour suggérer empiriquement l'implication de l'enchevêtrement, il faudrait concevoir une expérience qui pourrait perturber les paires de radicaux enchevêtrées sans perturber les autres paires de radicaux, ou vice versa, qui devrait d'abord être démontrée en laboratoire avant d'être appliquée aux paires de radicaux in vivo.
Notes et références
- « Quantum Biology », sur www.ks.uiuc.edu (consulté le )
- (en) « Quantum Biology: Powerful Computer Models Reveal Key Biological Mechanism », sur ScienceDaily (consulté le )
- Jennifer C. Brookes, « Quantum effects in biology: golden rule in enzymes, olfaction, photosynthesis and magnetodetection », Proceedings. Mathematical, Physical, and Engineering Sciences, vol. 473, no 2201, , p. 20160822 (ISSN 1364-5021, PMID 28588400, PMCID 5454345, DOI 10.1098/rspa.2016.0822, lire en ligne, consulté le )
- (en) Jim Al-Khalili, « How quantum biology might explain life's biggest questions » (consulté le )
- (en) Bey Hing Goh, Eng Siang Tong et Priyia Pusparajah, « Quantum Biology: Does quantum physics hold the key to revolutionizing medicine? », Progress in Drug Discovery & Biomedical Science, vol. 3, no 1, (ISSN 2710-6039, DOI 10.36877/pddbs.a0000130, lire en ligne, consulté le )
- (en) Lynn Margulis et Dorion Sagan, What Is Life?, Berkeley, University of California Press, , p. 1
- (en) Leyla Joaquim, Olival Freire et Charbel N. El-Hani, « Quantum Explorers: Bohr, Jordan, and Delbrück Venturing into Biology », Physics in Perspective, vol. 17, no 3, , p. 236–250 (ISSN 1422-6960, DOI 10.1007/s00016-015-0167-7, lire en ligne, consulté le )
- (en) P.O. Lowdin, Quantum genetics and the aperiodic solid. Some aspects on the Biological problems of heredity, mutations, aging and tumours in view of the quantum theory of the DNA molecule. Advances in Quantum Chemistry., vol. 2, Academic Press, , p. 213-360
- Jakub Dostál, Tomáš Mančal, Ramūnas Augulis et František Vácha, « Two-dimensional electronic spectroscopy reveals ultrafast energy diffusion in chlorosomes », Journal of the American Chemical Society, vol. 134, no 28, , p. 11611–11617 (ISSN 1520-5126, PMID 22690836, DOI 10.1021/ja3025627, lire en ligne, consulté le )
- Gregory S. Engel, Tessa R. Calhoun, Elizabeth L. Read et Tae-Kyu Ahn, « Evidence for wavelike energy transfer through quantum coherence in photosynthetic systems », Nature, vol. 446, no 7137, , p. 782–786 (ISSN 1476-4687, PMID 17429397, DOI 10.1038/nature05678, lire en ligne, consulté le )
- Elisabetta Collini, Cathy Y. Wong, Krystyna E. Wilk et Paul M. G. Curmi, « Coherently wired light-harvesting in photosynthetic marine algae at ambient temperature », Nature, vol. 463, no 7281, , p. 644–647 (ISSN 1476-4687, PMID 20130647, DOI 10.1038/nature08811, lire en ligne, consulté le )
- Roel Tempelaar, Thomas L. C. Jansen et Jasper Knoester, « Vibrational beatings conceal evidence of electronic coherence in the FMO light-harvesting complex », The Journal of Physical Chemistry. B, vol. 118, no 45, , p. 12865–12872 (ISSN 1520-5207, PMID 25321492, DOI 10.1021/jp510074q, lire en ligne, consulté le )
- Niklas Christensson, Harald F. Kauffmann, Tõnu Pullerits et Tomáš Mančal, « Origin of long-lived coherences in light-harvesting complexes », The Journal of Physical Chemistry. B, vol. 116, no 25, , p. 7449–7454 (ISSN 1520-5207, PMID 22642682, PMCID 3789255, DOI 10.1021/jp304649c, lire en ligne, consulté le )
- (en) Vytautas Butkus, Donatas Zigmantas, Leonas Valkunas et Darius Abramavicius, « Vibrational vs. electronic coherences in 2D spectrum of molecular systems », Chemical Physics Letters, vol. 545, , p. 40–43 (ISSN 0009-2614, DOI 10.1016/j.cplett.2012.07.014, lire en ligne, consulté le )
- Vivek Tiwari, William K. Peters et David M. Jonas, « Electronic resonance with anticorrelated pigment vibrations drives photosynthetic energy transfer outside the adiabatic framework », Proceedings of the National Academy of Sciences of the United States of America, vol. 110, no 4, , p. 1203–1208 (ISSN 1091-6490, PMID 23267114, PMCID 3557059, DOI 10.1073/pnas.1211157110, lire en ligne, consulté le )
- Erling Thyrhaug, Karel Žídek, Jakub Dostál et David Bína, « Exciton Structure and Energy Transfer in the Fenna-Matthews-Olson Complex », The Journal of Physical Chemistry Letters, vol. 7, no 9, 05 05, 2016, p. 1653–1660 (ISSN 1948-7185, PMID 27082631, DOI 10.1021/acs.jpclett.6b00534, lire en ligne, consulté le )
- Yuta Fujihashi, Graham R. Fleming et Akihito Ishizaki, « Impact of environmentally induced fluctuations on quantum mechanically mixed electronic and vibrational pigment states in photosynthetic energy transfer and 2D electronic spectra », The Journal of Chemical Physics, vol. 142, no 21, , p. 212403 (ISSN 1089-7690, PMID 26049423, DOI 10.1063/1.4914302, lire en ligne, consulté le )
- Adriana Marais, Betony Adams, Andrew K. Ringsmuth et Marco Ferretti, « The future of quantum biology », Journal of the Royal Society, Interface, vol. 15, no 148, 11 14, 2018 (ISSN 1742-5662, PMID 30429265, PMCID 6283985, DOI 10.1098/rsif.2018.0640, lire en ligne, consulté le )
- Masoud Mohseni, Patrick Rebentrost, Seth Lloyd et Alán Aspuru-Guzik, « Environment-assisted quantum walks in photosynthetic energy transfer », The Journal of Chemical Physics, vol. 129, no 17, , p. 174106 (ISSN 1089-7690, PMID 19045332, DOI 10.1063/1.3002335, lire en ligne, consulté le )
- (en) M B Plenio et S F Huelga, « Dephasing-assisted transport: quantum networks and biomolecules », New Journal of Physics, vol. 10, no 11, , p. 113019 (ISSN 1367-2630, DOI 10.1088/1367-2630/10/11/113019, lire en ligne, consulté le )
- (en) Seth Lloyd, « Optimal Energy Transport in Photosynthesis (Speech). From Atomic to Mesoscale: The Role of Quantum Coherence in Systems of Various Complexities. Institute for Theoretical, Atomic and Molecular and Optical Physics, Harvard-Smithsonian Center for Astrophysics, Cambridge, Massachusetts. » [vidéo], (consulté le )
- Mattia Walschaers, Jorge Fernandez-de-Cossio Diaz, Roberto Mulet et Andreas Buchleitner, « Optimally designed quantum transport across disordered networks », Physical Review Letters, vol. 111, no 18, , p. 180601 (ISSN 1079-7114, PMID 24237498, DOI 10.1103/PhysRevLett.111.180601, lire en ligne, consulté le )
- Alexei Halpin, Philip J. M. Johnson, Roel Tempelaar et R. Scott Murphy, « Two-dimensional spectroscopy of a molecular dimer unveils the effects of vibronic coupling on exciton coherences », Nature Chemistry, vol. 6, no 3, , p. 196–201 (ISSN 1755-4349, PMID 24557133, DOI 10.1038/nchem.1834, lire en ligne, consulté le )
- Hong-Guang Duan, Valentyn I. Prokhorenko, Richard J. Cogdell et Khuram Ashraf, « Nature does not rely on long-lived electronic quantum coherence for photosynthetic energy transfer », Proceedings of the National Academy of Sciences of the United States of America, vol. 114, no 32, 08 08, 2017, p. 8493–8498 (ISSN 1091-6490, PMID 28743751, PMCID 5559008, DOI 10.1073/pnas.1702261114, lire en ligne, consulté le )
- Jianshu Cao, Richard J. Cogdell, David F. Coker et Hong-Guang Duan, « Quantum biology revisited », Science Advances, vol. 6, no 14, , eaaz4888 (ISSN 2375-2548, PMID 32284982, PMCID 7124948, DOI 10.1126/sciadv.aaz4888, lire en ligne, consulté le )
- S. F. Huelga et M. B. Plenio, « Vibrations, quanta and biology », Contemporary Physics, vol. 54, no 4, , p. 181–207 (ISSN 0010-7514, DOI 10.1080/00405000.2013.829687, lire en ligne, consulté le )
- D. DeVault et B. Chance, « Studies of photosynthesis using a pulsed laser. I. Temperature dependence of cytochrome oxidation rate in chromatium. Evidence for tunneling », Biophysical Journal, vol. 6, no 6, , p. 825–847 (ISSN 0006-3495, PMID 5972381, PMCID 1368046, DOI 10.1016/s0006-3495(66)86698-5, lire en ligne, consulté le )
- (en) « DNA and Mutations », sur evolution.berkeley.edu
- Frank Trixler, « Quantum Tunnelling to the Origin and Evolution of Life », Current Organic Chemistry, vol. 17, no 16, , p. 1758–1770 (ISSN 1385-2728, PMID 24039543, PMCID 3768233, DOI 10.2174/13852728113179990083, lire en ligne, consulté le )
- (en) Sung-Lim Yu et Sung-Keun Lee, « Ultraviolet radiation: DNA damage, repair, and human disorders », Molecular & Cellular Toxicology, vol. 13, no 1, , p. 21–28 (ISSN 2092-8467, DOI 10.1007/s13273-017-0002-0, lire en ligne, consulté le )
- (en) Per-Olov Löwdin, « Proton Tunneling in DNA and its Biological Implications », Reviews of Modern Physics, vol. 35, no 3, , p. 724–732 (ISSN 0034-6861, DOI 10.1103/RevModPhys.35.724, lire en ligne, consulté le )
- (en) Johnjoe McFadden et Jim Al-Khalili, « The origins of quantum biology », Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences, vol. 474, no 2220, , p. 20180674 (ISSN 1364-5021 et 1471-2946, PMID 30602940, PMCID PMC6304024, DOI 10.1098/rspa.2018.0674, lire en ligne, consulté le )
- Watson, James (2012) The double helix. Hachette UK. ; voir p. 13
- (en) H.C. Longuet-Higgins, « Quantum Mechanics and Biology », Biophysical Journal, vol. 2, no 2, , p. 207–215 (PMID 14466521, PMCID PMC1366485, DOI 10.1016/S0006-3495(62)86957-4, lire en ligne, consulté le )
- von Bertalanffy L. (1928) Kritische theorie der formbildung. Berlin, Germany: Gebrüder Borntraeger Verlagsbuchhandlung.
- (en) N. Bohr, « Light and Life », Nature, vol. 131, no 3308, , p. 421–423 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/131421a0, lire en ligne, consulté le )
- Schrödinger E. (1944) What is life? | London, UK : Cambridge University Press.
- (de) P. Jordan, « Die Quantenmechanik und die Grundprobleme der Biologie und Psychologie », Die Naturwissenschaften, vol. 20, no 45, , p. 815–821 (ISSN 0028-1042 et 1432-1904, DOI 10.1007/BF01494844, lire en ligne, consulté le )
- Wigner E.P (1972) The place of consciousness in modern physics. In The collected works of Eugene Paul Wigner (Part B Historical, Philosophical, and Socio-Political Papers), vol. B/6, pp. 261–267. Berlin, Germany: Springer.
- H. L. Klopping, « Olfactory theories and the odors of small molecules », Journal of Agricultural and Food Chemistry, vol. 19, no 5, , p. 999–1004 (ISSN 0021-8561, PMID 5134656, DOI 10.1021/jf60177a002, lire en ligne, consulté le )
- (en) G. Malcolm Dyson, « The scientific basis of odour », Journal of the Society of Chemical Industry, vol. 57, no 28, , p. 647–651 (ISSN 1934-9971, DOI 10.1002/jctb.5000572802, lire en ligne, consulté le )
- L. Turin, « A spectroscopic mechanism for primary olfactory reception », Chemical Senses, vol. 21, no 6, , p. 773–791 (ISSN 0379-864X, PMID 8985605, DOI 10.1093/chemse/21.6.773, lire en ligne, consulté le )
- (en) « Odorant shape and vibration likely lead to olfaction satisfaction », sur phys.org (consulté le )
- (en) Linda Buck & Richard Axel, « A novel multigene family may encode odorant receptors: a molecular basis for odor recognition », Cell, 1re série, vol. 65, , p. 175-187 (lire en ligne)
- Eric Block, Victor S. Batista, Hiroaki Matsunami et Hanyi Zhuang, « The role of metals in mammalian olfaction of low molecular weight organosulfur compounds », Natural Product Reports, vol. 34, no 5, 05 10, 2017, p. 529–557 (ISSN 1460-4752, PMID 28471462, PMCID 5542778, DOI 10.1039/c7np00016b, lire en ligne, consulté le )
- Andreas Keller et Leslie B. Vosshall, « A psychophysical test of the vibration theory of olfaction », Nature Neuroscience, vol. 7, no 4, , p. 337–338 (ISSN 1097-6256, PMID 15034588, DOI 10.1038/nn1215, lire en ligne, consulté le )
- Philip J. M. Johnson, Marwa H. Farag, Alexei Halpin et Takefumi Morizumi, « The Primary Photochemistry of Vision Occurs at the Molecular Speed Limit », The Journal of Physical Chemistry. B, vol. 121, no 16, 04 27, 2017, p. 4040–4047 (ISSN 1520-5207, PMID 28358485, DOI 10.1021/acs.jpcb.7b02329, lire en ligne, consulté le )
- R. W. Schoenlein, L. A. Peteanu, R. A. Mathies et C. V. Shank, « The first step in vision: femtosecond isomerization of rhodopsin », Science (New York, N.Y.), vol. 254, no 5030, , p. 412–415 (ISSN 0036-8075, PMID 1925597, DOI 10.1126/science.1925597, lire en ligne, consulté le )
- « The Human Eye and Single Photons », sur math.ucr.edu (consulté le )
- M. Loulakis, G. Blatsios, C. S. Vrettou et I. K. Kominis, « Quantum Biometrics with Retinal Photon Counting », Physical Review Applied, vol. 8, no 4, , p. 044012 (DOI 10.1103/PhysRevApplied.8.044012, lire en ligne, consulté le )
- (en) « Quantum Biometrics Exploits the Human Eye’s Ability to Detect Single Photons », sur MIT Technology Review (consulté le )
- (en) Shireesh Apte, « Quantum biology: Harnessing nano-technology’s last frontier with modified excipients and food ingredients », Journal of Excipients and Food Chemicals, vol. 5, no 4, , p. 939 (lire en ligne, consulté le )
- Zachary D. Nagel et Judith P. Klinman, « Tunneling and dynamics in enzymatic hydride transfer », Chemical Reviews, vol. 106, no 8, , p. 3095–3118 (ISSN 0009-2665, PMID 16895320, DOI 10.1021/cr050301x, lire en ligne, consulté le )
- Harry B. Gray et Jay R. Winkler, « Electron tunneling through proteins », Quarterly Reviews of Biophysics, vol. 36, no 3, , p. 341–372 (ISSN 0033-5835, PMID 15029828, DOI 10.1017/s0033583503003913, lire en ligne, consulté le )
- (en) Neill Lambert, Yueh-Nan Chen, Yuan-Chung Cheng et Che-Ming Li, « Quantum biology », Nature Physics, vol. 9, no 1, , p. 10–18 (ISSN 1745-2481, DOI 10.1038/nphys2474, lire en ligne, consulté le )
- P. J. Hore et Henrik Mouritsen, « The Radical-Pair Mechanism of Magnetoreception », Annual Review of Biophysics, vol. 45, 07 05, 2016, p. 299–344 (ISSN 1936-1238, PMID 27216936, DOI 10.1146/annurev-biophys-032116-094545, lire en ligne, consulté le )
- (en) Klaus Schulten, Charles E. Swenberg et Albert Weller, « A Biomagnetic Sensory Mechanism Based on Magnetic Field Modulated Coherent Electron Spin Motion », Zeitschrift für Physikalische Chemie, vol. 111, no 1, , p. 1–5 (ISSN 2196-7156 et 0942-9352, DOI 10.1524/zpch.1978.111.1.001, lire en ligne, consulté le )
- Iannis K. Kominis, « The radical-pair mechanism as a paradigm for the emerging science of quantum biology », Modern Physics Letters B, vol. 29, no Supplement 1, , p. 1530013 (ISSN 0217-9849, DOI 10.1142/S0217984915300136, lire en ligne, consulté le )
- (en) Christopher T. Rodgers, « Magnetic field effects in chemical systems », Pure and Applied Chemistry, vol. 81, no 1, , p. 19–43 (ISSN 0033-4545 et 1365-3075, DOI 10.1351/PAC-CON-08-10-18, lire en ligne, consulté le )
- Ulrich E. Steiner et Thomas Ulrich, « Magnetic field effects in chemical kinetics and related phenomena », Chemical Reviews, vol. 89, no 1, , p. 51–147 (ISSN 0009-2665, DOI 10.1021/cr00091a003, lire en ligne, consulté le )
- (en) J. R. Woodward, « Radical Pairs in Solution: », Progress in Reaction Kinetics and Mechanism, (DOI 10.3184/007967402103165388, lire en ligne, consulté le )
- Roswitha Wiltschko, Margaret Ahmad, Christine Nießner et Dennis Gehring, « Light-dependent magnetoreception in birds: the crucial step occurs in the dark », Journal of the Royal Society, Interface, vol. 13, no 118, (ISSN 1742-5662, PMID 27146685, PMCID 4892254, DOI 10.1098/rsif.2015.1010, lire en ligne, consulté le )
- (en) Raphael D. Levine, Molecular Reaction Dynamics, Cambridge University Press, (ISBN 978-0-521-84276-1), p. 16-18
- (en) Harald Krug; Harald Brune; Gunter Schmid; Ulrich Simon; Viola Vogel; Daniel Wyrwa; Holger Ernst; Armin Grunwald; Werner Grunwald; Heinrich Hofmann, Nanotechnology : Assessment and Perspectives, Springer-Verlag Berlin and Heidelberg GmbH & Co. K., , 496 p. (ISBN 978-3-540-32819-3), p. 197-240
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Quantum biology » (voir la liste des auteurs).
- Cet article est partiellement ou en totalité issu de l'article intitulé « Acide désoxyribonucléique » (voir la liste des auteurs).
Vidéographie
- (en) Quantum Biology Explains Mysteries ; 11 nov. 2018
- Jim Al-Khalili (2015) TedX : [How Quantum Biology Might Explain Life’s Biggest Questions] | TED Talks ; mis en ligne le 16 sept. Londres, juin 2015
- (en) Quantum Biology: The Hidden Nature of Nature, World Science Festival, avec Paul Davies, Seth Lloyd, Thorsten Ritz | modérateur : John Hockenberry | mis en ligne 17 sept. 2015
- (en) An Introduction to Quantum Biology conférence de Philip Ball ; 18 févr 2015
- (en) Quantum Biology (Partie 1 : How Plants Use Quantum Mechanics) 17 févr. 2020
- (en) Birgitta Whaley (2020) The Renaissance of Quantum Biology (KITP Public Lecture by K. Birgitta Whaley) ; 19 juin 2020
Bibliographie
- Al-Khalili J, McFadden J, (2014), Life on the edge: the coming of age of quantum biology. London, UK: Bantam Press
- Ball, P. (2011). Physics of life: The dawn of quantum biology. Nature, 474(7351), 272.
- (en) Gregory S. Engel, Tessa R. Calhoun, Elizabeth L. Read et Tae-Kyu Ahn, « Evidence for wavelike energy transfer through quantum coherence in photosynthetic systems », Nature, vol. 446, no 7137, , p. 782–786 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature05678, lire en ligne, consulté le )
- (en) P. Hore et M. Rooman, « Discussions on Session 5B:Quantum effects in biology: enzyme activity, bird navigation », Procedia Chemistry, vol. 3, no 1, , p. 316–321 (DOI 10.1016/j.proche.2011.08.039, lire en ligne, consulté le )
- (en) H. Lee, Y.-C. Cheng et G. R. Fleming, « Coherence Dynamics in Photosynthesis: Protein Protection of Excitonic Coherence », Science, vol. 316, no 5830, , p. 1462–1465 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1142188, lire en ligne, consulté le )
- (en) Johnjoe McFadden et Jim Al-Khalili, « The origins of quantum biology », Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences, vol. 474, no 2220, , p. 20180674 (ISSN 1364-5021 et 1471-2946, PMID 30602940, PMCID PMC6304024, DOI 10.1098/rspa.2018.0674, lire en ligne, consulté le )
- (de) P. Jordan, « Die Quantenmechanik und die Grundprobleme der Biologie und Psychologie », Die Naturwissenschaften, vol. 20, no 45, , p. 815–821 (ISSN 0028-1042 et 1432-1904, DOI 10.1007/BF01494844, lire en ligne, consulté le )
- (en) Gregory D. Scholes, Graham R. Fleming, Lin X. Chen et Alán Aspuru-Guzik, « Using coherence to enhance function in chemical and biophysical systems », Nature, vol. 543, no 7647, , p. 647–656 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature21425, lire en ligne, consulté le )
- Scott Waring, « Quantum Biology: A Scientific Revolution in our Understanding of Biological Systems », Biological Systems: Open Access, vol. 07, no 01, (DOI 10.4172/2329-6577.1000185, lire en ligne, consulté le )
- Mohseni M, Omar Y, Engel GS, Plenio MB (eds). (2013) Quantum effects in biology. Cambridge, UK: Cambridge University Press
- Masoud Mohseni, Yasser Omar, Gregory S. Engel, Quantum Effects in Biology, (œuvre littéraire), Cambridge University Press, :
- Johnjoe Mac Fadden, Jim Al-Khalili, Life on Edge, (œuvre littéraire), Crown Publishing Group,
- Portail de la physique
- Portail de la biologie