Xylidine
La xylidine est un composé aromatique de formule brute C6H3(CH3)2(NH2), constituée d'un cycle benzénique substitué par un groupe amine (aniline) et deux groupes méthyle. Contrairement aux autres isomères de la diméthylaniline dont elle fait partie, aucun des groupes méthyle de la xylidine ne substitue sur le groupe amine (qui reste donc une amine primaire, contrairement par exemple à la N,N-diméthylaniline qui est une amine tertiaire), mais sont tous sur le cycle benzénique. Du fait de la position relative possible des trois substituants sur le cycle, la xylidine existe sous la forme de six isomères.
Propriétés
| Xylidine | ||||||
|---|---|---|---|---|---|---|
| Nom | 2,3-xylidine | 2,4-xylidine | 2,5-xylidine | 2,6-xylidine | 3,4-xylidine | 3,5-xylidine |
| Synonymes | 2,3-diméthylaniline 1-amino-2,3-diméthylbenzène |
2,4-diméthylaniline 1-amino-2,4-diméthylbenzène |
2,5-diméthylaniline 1-amino-2,5-diméthylbenzène |
2,6-diméthylaniline 1-amino-2,6-diméthylbenzène |
3,4-diméthylaniline 1-amino-3,4-diméthylbenzène |
3,5-diméthylaniline 1-amino-3,5-diméthylbenzène |
| Structure | 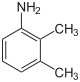 |
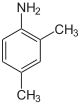 |
 |
 |
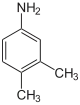 |
 |
| Numéro CAS | ||||||
| (mélange d'isomères) | ||||||
| Numéro EINECS | 201-755-0 | 202-440-0 | 202-451-0 | 201-758-7 | 202-437-4 | 203-607-0 |
| 215-091-4 (mélange d'isomères) | ||||||
| PubChem | 6893 | 7250 | 7259 | 6896 | 7248 | 7949 |
| Formule brute | C8H11N | |||||
| Masse molaire | 121,18 g/mol | |||||
| État (CNTP) | Liquide | Solide | Liquide | |||
| Apparence | Liquide incolore à jaunâtre (sauf 3,4-, solide cristallin incolore), tendance à noircir à la lumière | |||||
| Point de fusion | 2 °C[1] | −16 °C[2] | 15,5 °C[3] | 11,2 °C[4] | 51 °C[5] | 9,8 °C[6] |
| Point d'ébullition | 222 °C[1] | 214 °C[2] | 218 °C[3] | 215 °C[4] | 228 °C[5] | 220 °C[6] |
| Point d'éclair (coupelle fermée) |
96 °C[1] | 90 °C[2] | 93 °C[3] | 91 °C[4] | 98 °C[5] | 93 °C[6] |
| Point d'auto-inflammation | 545 °C[1] | 520 °C[2] | 520 °C[3] | 490 °C[4] | 580 °C[5] | |
| Masse volumique (20 °C) |
0,99 g·cm-3[1] | 0,99 g·cm-3[2] | 0,98 g·cm-3[3] | 0,98 g·cm-3[4] | 1,07 g·cm-3[5] | 0,97 g·cm-3[6] |
| solubilité (eau, 20 °C) |
1,5 g·l-1[1] | 5 g·l-1[2] | 5,6 g·l-1 (12 °C)[3] | 13 g·l-1[4] | 1,1 g·l-1 (25 °C)[5] | 4,8 g·l-1[6] |
| Pression de vapeur saturante |
13 Pa (25 °C)[1] | 11 Pa (20 °C) 27 Pa (30 °C) 1 hPa (50 °C)[2] |
20 Pa (25 °C)[3] | 20 Pa (20 °C) 47 Pa (30 °C) 2 hPa (50 °C)[4] |
3,7 Pa (25 °C)[5] | 1,3 hPa (20 °C)[6] |
| Limites d'explosivité | 1 ― 2,7 vol.%[1] | 1,1 ― 7,0 vol.% (85 °C)[2] | 1,3 ― 6,9 vol.%[4] | |||
| pKa[7] (acide conjugué) |
4,70 | 4,89 | 4,53 | 3,95 | 5,17 | 4,91 |
| LogP | 1,68[2] | 1,83[3] | 1,84[4] | 1,86[5] | 2,09[6] | |
| SGH |
   [1],[2],[3] |
   Danger[4] |
   [5],[6] | |||
| Phrase H et P | H301, H311, H331, H373 et H411 |
H302, H312, H315, H332, H335, H351 et H411 |
H301, H311, H331, H373 et H411 | |||
| P273, P280 et P304+P340 P302+P352 et P309+P310 |
P273, P280 et P302+P352 P304+P340 et P309+P310 |
P273, P280, P309 et P310 |
P260, P262, P273, P280 et P281 P302+P352, P304+P340 et P308+P313 |
P273, P280 et P304+P340 P302+P352 et P309+P310 |
P273, P280, P309, P310 et P302+P352 | |
À l'exception 3,4-xylidine qui est un solide, tous les isomères se présentent sous forme d'un liquide jaunâtre noircissant à l'air libre et à la lumière. Ils sont peu solubles dans l'eau et miscibles dans l'éthanol et l'éther. Ce sont des combustibles stables qui réagissent avec les oxydants forts.
Extraction
On obtient les xylidines par distillation fractionnée du goudron.
Synthèse
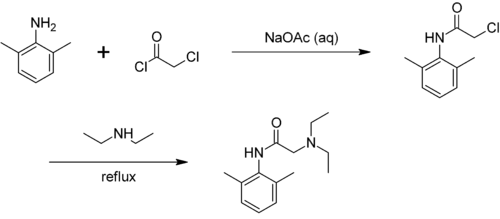
Les xylidines peuvent être obtenues à partir des xylènes. La nitration de ces dernières produit les nitroxylènes qui peuvent ensuite être réduites en xylidines. On obtient alors un mélange d'isomères, qu'on sépare ensuite. Par exemple, on extrait la 2,6-xylidine en ajoutant de l'acide chlorhydrique.
Utilisations
Les xylidines sont essentiellement utilisées dans la production de pigments et de colorants, dans divers antioxydants, dans certains composés agrochimiques ou pharmaceutiques, et dans un certain nombre d'autres procédés. On les utilise également en astronautique dans un carburant appelé Tonka-250.
L'isomère 2,3- est utilisé dans la synthèse de l'acide méfénamique, le 2,6- pour produire des anesthésiques (par exemple la lidocaïne), et le 3,4- dans la synthèse de la Vitamine B2.
Notes et références
- Entrée « 2,3-Dimethylaniline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 août 2019 (JavaScript nécessaire).
- Entrée « 2,4-Dimethylaniline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 août 2019 (JavaScript nécessaire).
- Entrée « 2,5-Dimethylaniline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 août 2019 (JavaScript nécessaire).
- Entrée « 2,6-Dimethylaniline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 août 2019 (JavaScript nécessaire).
- Entrée « 3,4-Dimethylaniline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 août 2019 (JavaScript nécessaire).
- Entrée « 3,5-Dimethylaniline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 août 2019 (JavaScript nécessaire).
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, (ISBN 0-8493-0303-6).