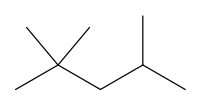
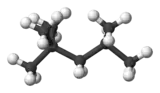
Isooctane
Le 2,2,4-triméthylpentane, ou isooctane, est un hydrocarbure de formule brute C8H18. C'est un isomère de l'octane.
| Iso-octane | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2,2,4-triméthylpentane | |
| No CAS | ||
| No ECHA | 100.007.964 | |
| No CE | 208-759-1 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, d'odeur caractéristique[1]. | |
| Propriétés chimiques | ||
| Formule | C8H18 [Isomères] (CH3)3CCH2CH(CH3)2 |
|
| Masse molaire[2] | 114,2285 ± 0,0077 g/mol C 84,12 %, H 15,88 %, |
|
| Propriétés physiques | ||
| T° fusion | −107 °C[1] | |
| T° ébullition | 99,23 °C [3] | |
| Solubilité | dans l'eau : nulle[1] | |
| Paramètre de solubilité δ | 14,7 J1/2·cm-3/2 (25 °C)[4] | |
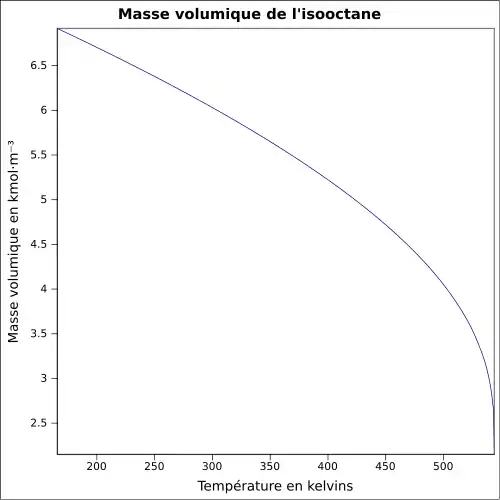
| Masse volumique | 0,69 g·cm-3[1]
|
|
| T° d'auto-inflammation | 417 °C[1] | |
| Point d’éclair | 4,5 °C (coupelle ouverte)[1] | |
| Limites d’explosivité dans l’air | 1,1–6,0 %vol[1] | |
| Pression de vapeur saturante | à 20 °C : 5,1 kPa[1]
|
|
| Point critique | 2 568 kPa [6], 270,65 °C [3] | |
| Thermochimie | ||
| Cp | ||
| Propriétés optiques | ||
| Indice de réfraction | 1,3890 [4] | |
| Précautions | ||
| NFPA 704 | ||
| Directive 67/548/EEC | ||
 Xn  F  N |
||
| Transport | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Utilisations
L'iso-octane est un type de carburant à huit atomes de carbone. L'essence est un mélange de diverses molécules comme l'octane. Certaines d'entre elles (tel l'octane ordinaire) sont des chaînes carbonées linéaires. L'iso-octane (exemple d’hydrocarbure à chaîne ramifiée) présente des embranchements et est considéré comme un des meilleurs carburants dans la mesure où il brûle uniformément. Contrairement aux hydrocarbures à chaîne linéaire qui s’enflamment en explosant à l’intérieur des moteurs, les hydrocarbures à chaîne ramifiée brûlent doucement en chauffant le gaz dans le cylindre et exercent ainsi une pression constante sur le piston. L’aptitude à brûler doucement est ‘l’indice d'octane’ du carburant : 100 pour l’iso-octane.
L’heptane (7 atomes de carbone) ne fait que détoner : indice d’octane = 0. Un carburant d’indice 95 contient l'équivalent de 95 % d'iso-octane et de 5 % d'heptane. Il faut toutefois signaler que l'indice d'octane se réfère à une échelle purement comparative, prenant ses repères de 0 et 100 respectivement sur l'heptane et l'iso-octane. Des carburants réels peuvent avoir un indice d'octane supérieur à 100.
L'isooctane est utilisé comme solvant pour certaines analyses en spectrophotométrie, en particulier pour l'extinction spécifique à 232 et 270 nm dans les huiles alimentaires.
Notes et références
- TRIMETHYL - 2, 2, 4 PENTANE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 32, no 4, , p. 1411 (DOI 10.1063/1.1556431)
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Pressures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 35, no 4, , p. 1461 (DOI 10.1063/1.2201061)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Inorganic Compounds and Elements, vol. 3, Huston, Texas, Gulf Pub. Co., , 384 p. (ISBN 0-88415-859-4)
- Portail de la chimie