Élagage synaptique
L'élagage synaptique est le processus d'élimination des synapses qui se produit entre la petite enfance et le début de la puberté chez les humains. Le même phénomène se produit chez de nombreux mammifères. Ce mécanisme comprend d'une part l'élagage des axones et d'autre part celui des dendrites.
Pour les articles homonymes, voir élagage et élagage alpha-bêta.

L'élagage des connexions synaptiques, étroitement associé à la phase d'apprentissage et au développement neurocognitif de l'enfant, permet d'affiner les faisceaux neuronaux, mais également d'éliminer les structures neuronales devenues obsolètes ou déficientes. À cet effet, ce processus présente un caractère sélectif et joue un rôle de régulateur synaptique.
Contexte neurocognitif et développemental

L'élagage synaptique est un mécanisme biologique intervenant au cours du neurodéveloppement et qui consiste dans l'élimination massives de synapses, qui permet une meilleure utilisation du réseau synaptique et donc une meilleure efficacité du cerveau[1],[2]. Bien qu'il soit essentiellement observable chez les humains, de nombreux travaux de recherches permettant d'étudier ce processus neurobiologique ont été réalisés sur des mammifères[3],[4]. Ces études ont mis en évidence que d'autres espèces parmi les mammifères, notamment les primates, sont également soumises au processus d'élagage synaptique[5],[6]. L'élagage des synapses chez l'humain débute dès la naissance du nouveau-né mais il est surtout observé ultérieurement avec la phase de maturation sexuelle (ou puberté)[7],[2].
À la naissance, le cerveau humain comporte environ 100 milliards de neurones et un nombre similaire de cellules cérébrales non neuronales[8]. Le nombre neurones est estimé à 86,1 milliards ± 8,1 millions de neurones à l'âge adulte[9]. Tandis que certains facteurs poursuivent le développement des cellules du cerveau et la croissance du cerveau, d'autres facteurs éliminent certaines cellules et certaines connexions afin de rendre le réseau et le fonctionnement cérébral plus efficace. Ainsi, deux facteurs contribuent au développement cérébral : d'une part l'importante croissance des connexions synaptiques entre les neurones, également connue sous les termes de « synaptogenèse exhubérante » lorsque l'individu atteint l'âge de 2 ou 3 ans[Note 1], et d'autre part la myélinisation des fibres nerveuses[8],[10],[11],[12]. Cependant, le nombre total de neurones commence à diminuer par un processus de mort cellulaire programmée (apoptose) et malgré le processus de neurogenèse qui se poursuit mais de manière fortement ralentie[10],[8].
Description générale


Pendant l'enfance, les synapses se multiplient, tandis qu'après l'adolescence, le volume des connexions synaptiques diminue en raison de l'élagage synaptique[10],[13]. Ainsi, la période de développement massif de connexions synaptiques de l'enfance est suivie par une période d'élagage. L'expression vient d'une analogie avec le développement d'arbres ou de buissons en biologie : on peut comparer les connexions synaptiques à des branches d'arbres qui grandissent et se consolident ; l'élagage consiste à couper et réduire ces ramifications trop nombreuses et inutiles[2]. Ainsi, la modélisation d'un élagage stéréotypé peut trouver une analogie avec la « taille d'un arbre », les cellules gliales faisant alors office de « jardiniers »[14].
L'élagage synaptique s'effectue en parallèle des transformations de la synaptophysine[Note 2]. Il est impliqué dans les changements de volume cérébral et de densité synaptique[12] : les rapports entre matière blanche et matière grise sont modifiés[13]. À partir de l'adolescence, le volume de substance grise subie une phase de décroissance[13]. Cette phase de diminution, qui se poursuit jusqu'à l'âge adulte, concorde avec celle des mécanismes de myélinisation[13]. En outre, alors que le niveau de substance grise suit une courbe de forme curviligne inversée, celui de la substance blanche montre une évolution linéaire[13].
Au cours des stades de développement infantile et pubère, le processus d'élagage synaptique évolue différemment en fonction des différentes aires cérébrales[12],[15]. Dans un premier temps, pendant l'enfance, l'élagage synaptique prend place essentiellement sur les zones motrices et sensorielles, aires dites « primaires »[12]. Ultérieurement, l'élagage affecte des zones impliquant les traitements de l'information plus complexe, telles que le cortex préfrontal[12],[15].
Le mécanisme d'élagage se présente comme une « réponse » provenant des neurones lorsqu'ils sont influencés par des facteurs environnementaux et des stimuli externes[16],[10],[17]. Ce mécanisme de régulation est considéré comme étant étroitement lié à l'apprentissage[10],[8],[17]. Depuis le début des années 1990, des travaux réalisés par technique d'imagerie cérébrale ont pu mettre en évidence que l'élagage synaptique accompagne le développement neurocognitif de l'enfant[18]. Dans cette même optique, des études scientifiques ont permis d'observer que ce processus synaptique, facteur lié à un phénomène de type homéostatique, intervient essentiellement au cours des phases de repos[19],[20],[21].
Découverte et premiers travaux de recherches
Dans la première moitié des années 1970, Brian Cragg publia une série d'études sur le développement et la plasticité synaptique chez le rat et surtout chez le chat avant de poursuivre ses recherches chez l'humain[22]. En 1975, l'une de ses études lui permit d'aboutir à des estimations de densité synaptique dans le cortex visuel du chat à différents stades de son développement de 37 jours de gestation à l'âge adulte. Il observa ainsi un accroissement rapide de la densité synaptique entre 8 et 37 jours après la naissance. Il put aussi estimer que la densité synaptique augmente jusqu'à atteindre un pic d'environ 13 000 synapses par neurone, sept semaines après la naissance et il mit en évidence une diminution de la densité synaptique, toujours dans le cortex visuel du chat, pour atteindre des valeurs légèrement inférieures aux valeurs maximales alors que les cellules gliales continuent de se développer[23]. La même année (1975), Cragg publia l'une des premières études sur la densité des synapses (et des neurones) pour le cerveau humain en étudiant les lobes frontal et temporal de personnes âgées dont 3 avec un retard mental sévère chez lesquelles il mit en évidence des nombres de synapses légèrement plus élevés par rapport à un groupe de personnes contrôle[24].
Deux ans plus tard, Jennifer Lund (en) et ses collègues obtinrent des résultats similaires en étudiant le développement du cortex visuel chez le singe mettant en évidence l'élagage des épines dendritiques[25],[26] et, à nouveau, en 1979[27]. Lund et ses collègues suggérèrent alors l'idée « que l'élimination des contacts synaptiques peut être aussi sélective et constructive envers la fonction finale du neurone visuellement altéré que la formation de contacts synaptiques spécifiques »[25],[26].
Les recherches se poursuivirent dans les années 1980 révélant le phénomène d'élagage synaptique avec des études concernant d'autres aires corticales chez l'animal notamment avec les travaux de Pasko Rakic, Patricia Goldman-Rakic et leurs collègues qui, en plus de l'aire visuelle, étudièrent chez le singe les aires somatosensorielle et motrice de même que le cortex préfrontal[26]. Une autre étude réalisée en 1993 permit à Pasko Rakic et J.P. Bourgeois de découvrir chez le singe qu'après une période durant laquelle se produit une augmentation extraordinairement rapide de la densité synaptique, celle-ci atteint un plateau à l'âge de la maturité sexuelle de l'animal (3 ans). À ce stade, les zones du cortex suivent une maturation qui diffère d'une zone à l'autre : alors que la densité synaptique commence à diminuer rapidement avant de se stabiliser à l'âge de 4-5 ans pour les aires somatosensorielle et motrice, il en va autrement pour le cortex préfrontal pour lequel les chercheurs ont observé une diminution progressive de la densité synaptique à partir de 3 ans et qui se poursuit tout au long de la vie de l'animal au lieu de se stabiliser. En approfondissant leur analyse, ils furent amenés à conclure à une véritable diminution du nombre de synapses et non pas à une simple diminution de la densité synaptique due à l'augmentation du volume du cerveau au cours du développement. Ils évaluèrent ainsi que sur une période de 2 à 3 années, 2 500 synapses disparaissent chaque seconde dans l'aire visuelle primaire dans chaque hémisphère du cerveau[28],[26].
Variations
Élagage de régulation
À la naissance, les neurones, au sein des cortex cérébraux visuel et moteur sont étroitement associés au colliculus supérieur, à la moelle épinière, mais également au pont — partie médio-supérieure du tronc cérébral, également connue sous les termes de « pont de Varole » —. Les neurones de chaque cortex sont sélectivement élagués, ce qui laisse les connexions avec les centres de traitement fonctionnellement appropriés. Par conséquent, les neurones du cortex visuel élèvent les synapses avec des neurones dans la moelle épinière, et le cortex moteur coupe les connexions avec le colliculus supérieur. Cette variation d'élagage est connue sous le nom d'« élagage à l'axone stéréotypé à grande échelle ». Les neurones étendent des branches axiales longues dans des zones cibles appropriées ou inappropriées. Lors de cette phase, les connexions inappropriées sont, à terme, éliminées[29].
Les événements régressifs affinent l'abondance des connexions, liaisons réalisées au cours la neurogenèse, afin de créer un circuit spécifique et mature[30]. La neurolyse, processus déterminé par apoptose de la cellule nerveuse et l'élagage sont les deux principales phénomènes biologiques permettant la séparation des connexions synaptiques indésirables. Lors de l'apoptose, les neurones sont supprimés et toutes les connexions qui lui sont associées sont également éliminées. En revanche, au cours d'un processus d'élagage, le neurone qui ne meurt pas, nécessite toutefois la rétraction des axones à partir de connexions synaptiques qui ne sont pas fonctionnellement appropriées[31].
Il a été établi que la finalité ou l'objectif d'un élagage synaptique est d'éliminer les structures neuronales du cerveau inutiles[32]. Ainsi, à mesure que le cerveau humain se développe, la nécessité de comprendre des structures plus complexes devient beaucoup plus pertinente, et les associations plus simples formées à l'enfance sont prédestinées à être remplacer par des structures plus complexes[32].
Bien qu'il existe plusieurs relations entre ce mécanisme d'élimination synaptique et la régulation du développement cognitif de l'enfance, l'élagage se révèle être un processus de suppression des neurones qui peuvent être endommagés ou dégradés afin d'améliorer et de faciliter la capacité de « mise en réseau » d'une zone particulière du cerveau[32]. En outre, il a été déterminé que le mécanisme ne fonctionne pas seulement en matière de développement et de réparation, mais aussi comme moyen de maintenir continuellement une fonction cérébrale plus opérante en éliminant les neurones dont l'efficacité synaptique est faible[32]. D'après Jean-Pierre Changeux, neurobiologiste au Collège de France, l'élagage synaptique procède d'une « stabilisation sélective des synapses par un mécanisme de darwinisme neuronal »[18].
Élagage lors de la maturation du cerveau

L'élagage qui est lié à l'apprentissage est connu sous le nom d'« élagage de l'axe de l'axone à petite échelle »[29]. Les axones étendent leurs terminaisons axiales courtes vers les neurones au sein d'une zone cible[29]. Certaines de ces terminaisons sont alors éliminées par effet de « concurrence »[16]. La forme de sélection des liaisons axonales suit le principe de « l'utiliser ou de le perdre », cette propriété sélective étant déterminée selon la plasticité synaptique[33]. Cela signifie que les synapses fréquemment utilisées ont des connexions fortes alors que les synapses rarement utilisées sont éliminées. Les exemples observés chez les vertébrés comprennent l'élagage des extrémités axonales au niveau de la jonction neuromusculaire, laquelle est localisée dans le système nerveux périphérique, mais également l'élagage de l'entrée des fibres du cervelet, structure de l'encéphale qui est en relation avec l'ensemble du système nerveux central[29],[33].
Dans l'espèce humaine, l'existence de l'élagage synaptique a pu être établi grâce à l'observation des différences dans les estimations de cellules gliales et de neurones entre les enfants et les adultes : ce nombre diffère considérablement dans le noyau thalamique médiodorsal entre les deux populations étudiées[34].
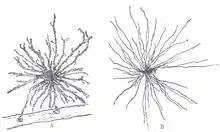
Au cours d'une étude menée en 2007 à l'Université d'Oxford, des chercheurs ont comparé 8 cerveaux humains de nouveau-nés avec ceux de 8 adultes. Ces travaux ont été réalisés en utilisant des estimations basées sur la taille et les preuves recueillies à partir du fractionnement stéréologique. Ils ont montré que, en moyenne, les estimations des populations de neurones adultes étaient inférieures de 41 % à celles des nouveau-nés dans la région qu'ils mesuraient, le noyau thalamique médiodorsal[34].
Cependant, en ce qui concerne le nombre total de cellules gliales, leur nombre est plus élevé chez les adultes que chez les nouveau-nés : 36,3 millions en moyenne chez les adultes, contre 10,6 millions chez les nouveau-nés[34]. La structure du cerveau est censée changer lorsque la dégénérescence et la défaillance se produisent dans des situations postnatales, bien que ces phénomènes n'aient pas été observés dans certaines études[34]. Pendant la phase de développement, il est peu probable que les neurones qui se trouvent en voie de perte par mort cellulaire programmée soient réutilisés, mais plutôt remplacés par de nouvelles structures neuronales ou synaptiques. Ces mécanismes se sont révélés parallèles aux changements structurels au sein de la matière grise sous-corticale[35].
L'élagage synaptique est répertorié séparément des événements régressifs observés concernant les individus plus âgés. Bien que l'élagage du développement dépende de l'expérience, la détérioration des connexions, processus synonyme de vieillesse, ne le sont pas.
Mécanismes expliquant l'élagage synaptique
Les trois modèles expliquant l'élagage synaptique sont la dégénérescence axonale, la rétraction axonale et l'excrétion d'axones. Dans tous les cas, les synapses sont formées par un terminal d'axone transitoire, et l'élimination des synapses est causée par l'élagage des axones. Chaque modèle offre une méthode différente dans laquelle l'axone est supprimé pour supprimer la synapse. Dans l'élagage d'axone à petite échelle, l'activité neurale est considérée comme un régulateur important, mais le mécanisme moléculaire demeure incertain. D'autre part, il est probable que les hormones et les facteurs trophiques sont les principaux facteurs extrinsèques qui régissent l'élagage des axones stéréotypés à grande échelle[29].
Dégénérescence axonale
Chez une espèce telle que la drosophile, des changements importants ont été apportés au système nerveux pendant sa métamorphose. La métamorphose est déclenchée par l'ecdysone (une molécule hormonale de type stéroïdien) et, au cours de cette même période, un élagage et une réorganisation étendus au niveau du réseau neuronal se produisent. Ainsi, cette observation a permis d'établir que l'élagage synaptique chez cet insecte se déclenche lorsque les récepteurs de l'ecdysone sont activés. Les études de dénervation à la jonction neuromusculaire des vertébrés ont montré que le mécanisme d'élimination des axones s'apparente de manière significative à la dégénérescence wallérienne[36]. En revanche, le processus d'élimination synaptique global et simultané qui a été observé chez la drosophile diffère de l'élagage du système nerveux des mammifères, ce dernier se produisant localement et sur plusieurs phases de développement[29].
Rétractation axonale


Les branches de l'axone se rétractent de manière distale (proche de l'extrémité d'un membre) à proximale (près de la base d'un membre). Dans ce cas, il est très probable que les contenus axonaux rétractés soient recyclés dans d'autres parties de l'axone. Toutefois, le mécanisme biologique par lequel l'élagage axonal survient demeure encore incertain concernant le système nerveux central des mammifères. Des études sur la souris ont mis en évidence que l'élagage pourrait être associé à des molécules dite d'« orientation ». Les molécules de « guidage » servent à contrôler le repérage des axones par répulsion ainsi qu'à amorcer l'élagage de connexions synaptiques protubérantes. Les ligands des sémaphorines, les récepteurs des neuropilines 1 et 2, mais également ceux des plexines (en) sont utilisés pour induire la rétraction des axones pour initier l'élagage hippocampo-septal et le faisceau infrapyramidal (IPB). L'élagage stéréotypé des projections de l'hippocampe s'est avéré être significativement altéré chez les souris présentant un défaut en Plexin-A3. Plus précisément, les axones qui sont reliés à une cible transitoire se rétractent une fois que les récepteurs Plexin-A3 sont activés par les ligands de la classe 3 de la sémaphorine. Dans l'IPB, l'expression de l'ARNm pour sémaphorine 3F (en), présente dans l'hippocampe lors de la période prénatale, se perd après la naissance et retourne dans la strate de oriens (en) (une partie de l'hippocampe)[37],[38]. En parallèle, l'apparition de l'élagage IPB se produit approximativement au même moment. Dans le cas des projections de la zone hippocampo-septal, l'expression de l'ARNm cible qui créé la Sema3A, a été suivie par l'initiation de l'élagage après 3 jours. Cet élément suggère que l'élagage est déclenché une fois que le ligand atteint les niveaux de protéines de seuil quelques jours après l'apparition de l'ARNm détectable[39]. L'élagage des axones le long du tube corticospinal visuel (CST) est défectueux chez les mutants de neuropiline-2 ; tandis que pour les souris mutantes possédant un double plexin-A3 et plexin-A4, au cours du processus d'élagage, la Sema3F s'exprime normalement au sein de la moelle épinière. De surcroît, ces observations révèlent qu'il n'y a pas d'anomalie de taille du CST moteur observé chez les individus « double plexin-A3 et plexin-A4 »[29].

Un élagage stéréotypé a également été observé dans la fabrication de branches axonales surtendues lors de la formation de la rétinotopie[40]. Des études ont permis de démontrer que non seulement l'éphrine, mais également les récepteurs de cette molécule (Eph), régulent et dirigent les branches axiales de la rétine[41],[42],[43]. La signalisation avant entre Ephrine-A et EphA, le long de l'axe anatomique antérieur-postérieur, a pu être mise en évidence : à cet effet, cette interaction semble déterminer l'inhibition de la formation de branche axiale de la rétine postérieure avec une zone terminale[44]. La signalisation directe favorise également l'élagage des axones qui ont atteint la zone terminale[44]. En revanche, il n'a pas encore été clairement établi que le mécanisme de rétraction observé dans l'élagage IPB soit applicable pour les axones de la rétine[45].
La signalisation inverse entre les protéines éphrines B et leurs récepteurs tyrosines kinases Eph B a été révélée pour initier le mécanisme de rétraction dans l'IPB. En outre, des observations ont montré que la molécule Ephrin-B3 (en) transforme des signaux inverses dépendant de la phosphorylation de la tyrosine en axones de l'hippocampe qui déclenchent l'élagage des fibres IPB excessives[46],[47]. Le postulat proposé implique que EphB s'exprime à la surface des cellules cibles, ce qui entraînerait la phosphorylation de la tyrosine d'Ephrin-B3[46],[47]. La liaison essentielle d'Ephrin-B3 à la protéine adaptateur cytoplasmique Grb4[Note 3],[47] conduit au recrutement et à la liaison de Dock « 180 » et des kinases activées par les enzymes PKA[49],[50]. La liaison de Dock180 (en) augmente les niveaux Rac-GTP (en), et PKA sert à diriger la signalisation en aval du Rac actif qui conduit à la rétraction de l'axone, aboutissant ainsi à un éventuel élagage[48],[51],[49],[50].
Excrétion d'axosomes
L'imagerie en temps réel effectuée sur des axones en retrait dans les jonctions neuromusculaires de souris, a mis en évidence que l'élagage de l'axone pourrait être du à un phénomène d'excrétion. L'axone en retrait s'est déplacé dans un ordre distal à proximal ressemblant à une rétraction. Cependant, dans de nombreux cas, les restes étaient excrétés à mesure que les axones se rétractaient. Dans ce cas, les résidus axonaux, dénommés axosomes, contenaient les mêmes organites observées dans les bulbes attachés à l'extrémité des axones et se trouvaient généralement localisés à proximité de ces excroissances axonales. Cet élément indique que les axosomes sont dérivés des bulbes. Par ailleurs, les axosomes n'étaient pas pourvus de cytoplasmes riches en électrons ou de mitochondries dont les membranes ont été rompues, indiquant ainsi qu'ils n'étaient pas formés par une dégénérescence wallerienne[52].
Modélisation mathématique
Au cours la seconde moitié des années 1990, les neurobiologistes et mathématiciens Gal Cheichik, Isaac Meilijson et Eytan Rupin, de l'Université de Tel Aviv (département mathématiques et médecine), ont pu établir la modélisation mathématique du processus d'élagage synaptique[6]. Cette modélisation, qui prend appui sur la règle de Donald Hebb, peut être décrite par deux fonctions différentes[6].
- Le premier modèle donne :
« »
— Gal Cheichik, Isaac Meilijson et Eytan Rupin, 1997[6].
- Le second modèle s'écrit :
« »
— Gal Cheichik, Isaac Meilijson et Eytan Rupin, 1997[6].
Psychologie et psychiatrie
Amnésie infantile
Des études effectuées dans les années 1990, ont suggéré que les effets de l'élagage pourraient être impliqués dans l'apparition de l'amnésie infantile[6],[53]. Toutefois, au début des années 2000, cette hypothèse a été estimée peu probante[53]. Deux éléments viennent invalider l'implication de l'élagage dans ce type de perte mémoriel : d'une part les traces amnésiques ayant survécu à l'élagage synaptique demeurent actives ; d'autre part la loi de Ribot, théorie établissant que « les souvenirs les plus stables sont les plus anciens », ne peut corroborer ce postulat[53].
Schizophrénie et troubles bipolaires
Plusieurs maladies mentales graves, en particulier la schizophrénie, débutent durant l'adolescence. Une des hypothèses explicatives est un dysfonctionnement de l'élagage synaptique qui serait quatre fois important chez les jeunes schizophrènes que chez les jeunes sans troubles psychiatriques[54],[55],[56],[57]. Plus précisément, l'apparition de ce trouble psychiatrique pourrait trouver son origine dans un excès d'élimination affectant essentiellement les synapses cortico-corticales et cortico-sous-corticales, liaisons localisées au sein du cortex préfrontal, comme les connexions synaptiques de type glutamatergiques[55],[57]. Concernant ce groupe de synapses, un élagage excédentaire entraînerait un effet d'excitation neuronale amenuisée[Note 4],[55],[56],[57]. En outre, cet excès d'élagage, qui peut également apparaître au cours de l'enfance, diminuant alors le processus de myélinisation, pourrait affecter la connectivité cérébrale[56].
Autisme
À contrario de la schizophrénie, un déficit ou un affaiblissement de l'élagage, induisant ainsi une abondance excessive de liaisons synaptiques, pourrait générer des troubles autistiques[58],[59],[60],[61],[6]. La sur-activation de la molécule enzymatique mTOR apparaît être à l'origine de ce déficit d'élimination synaptique[62],[Note 5]. Ce dysfonctionnement peut-être également corrélé par une désactivation de la molécule de transmission MEF2[61].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Synaptic pruning » (voir la liste des auteurs).
Notes
- Au cours de l'enfance, chaque neurone créé en moyenne 2 500 connexions synaptiques, ce nombre atteignant un maximum de 15 000 liaisons synaptiques vers l'âge de 2 ou 3 ans[8]. En raison l'importance de ce pic synaptique, cette phase de développement cérébral est dénommée « synaptogenèse exhubérante »[8].
- Hormis son expression immunitaire, la synaptophysine, une molécule de type glycoprotéique, est également un marqueur de liaison synaptique[12].
- Cette protéine adaptrice de l'Ephrin-B3, est également dénommée « NCK2 » ou encore « NCKβ »[48],[49].
- Ce phénomène est également connu sous les termes d'« excitotoxicité glutamatergique », en raison de l'implication de l'acide glutamique[57].
- La même étude montre chez la souris que la rapamycine, un inhibiteur de l'enzyme mTOR, corrige ce déficit d'élagage chez le mutant Tsc2+ mais non chez la souris mutante Atg7CKO (2 types de souris transgéniques manifestant des troubles autistiques)[62].
Références
- (en) Society for Neuroscience, Brain Facts, A Primer on the Brain and Nervous System, USA, Society for Neuroscience, , 96 p. (lire en ligne), p. 16
- (en) The National Institute of Mental Health, « Development of the Young Brain », sur Brain Facts, (consulté le )
- Sébastien Magnico, « I.1 Dégénérescence axonale : un processus physiologique », dans Sébastien Magnico, Les mécanismes moléculaires de la dégénerescence axonale dans un contexte de type Dying back pattern. Neurosciences, Paris VI, Université Pierre et Marie Curie, , 269 p. (lire en ligne), pages 20 à 22.
- (en) G. Chechik, I. Meilijson et E. Ruppin, « Synaptic pruning in development : a computational account. », Neural computation, vol. 10, no 7, , p. 1759 à 1777 (PMID 9744896, DOI 10.1162/089976698300017124)
- (en) Gal Chechik, Isaac Meiljison et Eytan Ruppin, « Neuronal Regulation : A biologically plausible mechanism efficient synaptic pruning in brain development. », dans James Browner (directeur de publication) et al., Computational Neuroscience : Trends in Research, 1999, MIT press, , 1090 p. (lire en ligne), page 633.
- (en) Gal Cheichik et Isaac Meilijson, « Synaptic pruning in development : a computational account », publications de l'Université de Tel-Aviv - école de médecine et des sciences mathématiques, , p. 0 à 23 (lire en ligne [PDF], consulté le ).
- (en) J. Iglesias, J. Eriksson, F. Grize, M. Tomassini et A. Villa, « Dynamics of pruning in simulated large-scale spiking neural networks », BioSystems, vol. 79, no 9, , p. 11–20 (PMID 15649585, DOI 10.1016/j.biosystems.2004.09.016).
- Sandoval 2015, p. 1.
- (en) Frederico A.C. Azevedo, Lea T. Grinberg, José Marcelo Farfel, Renata E.L. Ferretti, Renata E.P. Leite et Ludmila R.B. Carvalho, « Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain », The Journal of comparative neurology, vol. 513, no 5, , p. 532 à 541 (PMID 19226510, DOI 10.1002/cne.21974, lire en ligne, consulté le ).
- (en) Fergus I. M. Craik et Ellen Bialystok, « Cognition through the lifespan : mechanisms of change », Trends in cognitive sciences, vol. 10, no 3, (DOI 10.1016/j.tics.2006.01.007, lire en ligne, consulté le ).
- P. S. Hüppi, C. Borradori Tolsa et S. Eliez, « Le développement du cerveau en images : maturation et pathologies cérébrales », Rev Med Suisse, (lire en ligne, consulté le ).
- Celso Arango, Carmen Moreno, Salvador Martinez et al., « Évolution des modifications cérébrales au cours des psychoses précoces », L'information psychiatrique, vol. 86, no 6, , paragraphe 2 : Considérations liées au développement cérébral (DOI 10.3917/inpsy.8606.0513., lire en ligne, consulté le ).
- Doudin et Tardiff 2016, p. 145.
- Sébastien Bohler, « Comment le cerveau élimine ses synapses : Les cellules microgliales sont chargées de « l'élagage synaptique » : elles éliminent les synapses les moins efficaces pour permettre aux autres de se renforcer. », Pour la science, (lire en ligne, consulté le ).
- (en) N. Gogtay, J. N. Giedd, L. Lusk, K. M. Hayashi, D. Greenstein et al., « Dynamic mapping of human cortical development during childhood through early adulthood », Proceedings of the National Academy of Sciences of the United States of America, vol. 101, no 21, , pages 8174 à 8179 (PMID 15148381, PMCID 419576, DOI 10.1073/pnas.0402680101).
- Collectif - Inserm, « Mécanismes impliqués dans le développement cérébral », dans Troubles mentaux : Dépistage et prévention chez l’enfant et l’adolescent, Publications de l'Inserm, (lire en ligne [PDF]), pages 259 et 271.
- Sandoval 2015, p. 2.
- Olivier Houdé, « Le rôle positif de l'inhibition dans le développement cognitif de l'enfant », Le Journal des psychologues, vol. 244, no 1, , pararaphe 12 (DOI 10.3917/jdp.244.0040., lire en ligne, consulté le ).
- Michelle Bureau, Pierre Genton et Charlotte Dravet, « Rôle du sommeil dans le développement cognitif et les interférences avec les anomalies EEG paroxystiques liées au sommeil », dans Bureau Michelle, Genton Pierre et Dravet Charlotte, Syndromes épileptiques de l'enfant et de l'adolescent - 5e édition, John Libbey Eurotext, , 682 p. (lire en ligne), page 263.
- Jensen et Ellis Nutt 2016, p. 51 à 57.
- Jean-Émile Vanderheyden (dir.), Stéphane Noël (dir.) et al., « Plasticité cérébrale et sommeil chez l'enfant : perturbations liées à l'épilepsie », dans Jean-Émile Vanderheyden, Stéphane Noël (directeurs d'ouvrage) et al., Bienfaits et troubles du sommeil : Comprendre pour mieux prendre en charge, De Boeck Superieur, , 507 p. (lire en ligne), page 205.
- (en) Brian Cragg, « Cragg BG., Selected items », sur le site PubMed (consulté le )
- (en) Brian Cragg, The development of synapses in the visual system of the cat., vol. 160, USA, Journal of Comparative Neurology, (DOI 10.1002/cne.901600202, lire en ligne), pages 147-166
- (en) Brian Cragg, The density of synapses and neurons in normal, mentally defective ageing human brains., vol. 160, R.-U., Brain, (DOI https://doi.org/10.1093/brain/98.1.81, lire en ligne), pages 81-90
- (en) Jennifer S. Lund, Ronald G. Boothe et Raymond Douglas Lund, « Development of Neurons in the Visual Cortex (Area 17) of the Monkey (Macaca nemistrina) : A Golgi Study from Fetal Day 127 to Postnatal Maturity. », Journal of Comparative Neurology, USA, vol. 160, no 2, , pages 147-166 (DOI 10.1002/cne.901760203, lire en ligne, consulté le )
- (en) John Bruer, « Neural Connections : Some You Use, Some You Lose », sur le site James S. McDonnell Foundation (consulté le )
- (en) Ronald G. Boothe, William T. Greenough, Jennifer S. Lund et Kathy Wrege, « A quantitative investigation of spine and dendrite development of neurons in visual cortex (area 17) of Macaca nemestrina monkeys. », Journal of Comparative Neurology, USA, vol. 160, no 2, , pages 147-166 (DOI 10.1002/cne.901860310, lire en ligne, consulté le )
- (en) J.P. Bourgeois et P. Rakic, « Changes of synaptic density in the primary visual cortex of the macaque monkey from fetal to adult stage. », Journal of Neuroscience, USA, vol. 13, no 7, , pages 2810-2820 (lire en ligne, consulté le )
- (en) P. Vanderhaeghen et H.J. Cheng, « Guidance Molecules in Axon Pruning and Cell Death », Cold Spring Harbor Perspectives in Biology, vol. 2, no 6, , pages 1 à 18 (PMID 20516131, PMCID 2869516, DOI 10.1101/cshperspect.a001859, lire en ligne, consulté le ).
- Paul Jacquin, « Introduction », Adolescence, t. 34, no 3, , paragraphe 2 (DOI 10.3917/ado.097.0475., lire en ligne, consulté le ).
- Kenneth J. Aitken et Colwyn Trevarthen, « L'organisation soi/autrui dans le développement psychologique humain », La psychiatrie de l'enfant, vol. 46, no 2, , page 484 (DOI 10.3917/psye.462.0471, lire en ligne [PDF], consulté le ).
- (en) Gal Chechik, Isaac Meilijison et Eytan Ruppin, « Neuronal Regulation : a mechanism for synaptic pruning during brain maturation », Neural Computation, vol. 11, no 8, , p. 2061–80 (PMID 10578044, DOI 10.1162/089976699300016089).
- Damon et Lerner 2006, p. 11.
- (en) Maja Abitz, Nielsen Rune Damgaard et al., « Excess of neurons in the human newborn mediodorsal thalamus compared with that of the adult », Cerebral Cortex, vol. 17, no 11, , p. 2573–2578 (PMID 17218480, DOI 10.1093/cercor/bhl163, lire en ligne, consulté le ).
- Fanny Dégeilh, Francis Eustache et Bérengère Guillery-Guichard, « Le développement cognitif et cérébral de la mémoire : de l'enfance à l'âge adulte », Biologie Aujourd'hui, (lire en ligne, consulté le ).
- (en) LK. Low et H.J. Cheng, « Axon pruning : an essential step underlying the developmental plasticity of neuronal connections », Philos Trans R Soc Lond B Biol Sci, vol. 361, , p. 1531–1544 (DOI 10.1098/rstb.2006.1883)
- (en) Gianmaria Maccaferri, « Stratum oriens horizontal interneurone diversity and hippocampal network dynamics », The Journal of Physiology, vol. 562, , p. 73 à 80 (PMCID 1665470, DOI 10.1113/jphysiol.2004.077081, lire en ligne, consulté le ).
- (en) Clara A. Amegandjin, Localisation régionale et subcellulaire du récepteur EphA7 dans l’hippocampe et le cervelet du rat adulte : Mémoire présenté à la Faculté de médecine en vue de l'obtention du grade de maîtrise en pathologie et biologie cellulaires Option système nerveux, Université de Montréal, (lire en ligne), page 51.
- (en) Anil Bagri, Hwai-Jong Cheng, Avraham Yaron, Samuel J. Pleasure et Tessier-Lavigne Marc, « Stereotyped Pruning of Long Hippocampal Axon Branches Triggered by Retraction Inducers of the Semaphorin Family », Cell, vol. 113, no 3, , p. 285–299 (PMID 12732138, DOI 10.1016/S0092-8674(03)00267-8)
- (en) F. Mann, S. Ray, W. Harris et C. Holt, « Topographic mapping in dorsoventral axis of the Xenopus retinotectal system depends on signaling through ephrin-B ligands », Neuron, vol. 35, no 3, , p. 461–473 (PMID 12165469, DOI 10.1016/S0896-6273(02)00786-9).
- (en) D.G. Wilkinson, « Multiple roles of EPH receptors and ephrins in neural development », Nature Reviews. Neuroscience, vol. 2, no 3, , p. 155–164 (PMID 11256076, DOI 10.1038/35058515).
- (en) H.J Cheng, M. Nakamoto, A.D. Bergemann et J.G. Flanagan, « Complementary gradients in expression and binding of ELF-1 and Mek4 in development of the topographic retinotectal projection map », Cell, vol. 82, no 3, , p. 371–381 (PMID 7634327, DOI 10.1016/0092-8674(95)90426-3).
- (en) U. Drescher, C. Kremoser, C. Handwerker et al., « In vitro guidance of retinal ganglion cell axons by RAGS, a 25 kDa tectal protein related to ligands for Eph receptor tyrosine kinases », Cell, vol. 82, no 3, , p. 359–370 (PMID 7634326, DOI 10.1016/0092-8674(95)90425-5).
- (en) Dina Arvanitis et Alice Davy, « Eph/ephrin signaling : networks », Genes & Development, (DOI 10.1101/gad.1630408, lire en ligne, consulté le ).
- L. Luo et G Flanagan, « Development of Continuous and Discrete Neural Maps », Neuron, vol. 56, no 2, , p. 284–300 (DOI 10.1016/j.neuron.2007.10.014).
- Clara A. Amegandjin, « 2. Récepteurs Eph et éphrines », dans Clara A. Amegandjin, Localisation régionale et subcellulaire du récepteur EphA7 dans l’hippocampe et le cervelet du rat adulte, Université de Montréal, , 117 p. (lire en ligne [PDF]), pages 8 à fin chapitre.
- (en) Dominique Bagnard, Axon Growth and Guidance, Springer Science & Business Media, 10 décémbre 2008, 170 p. (lire en ligne), pages 32 à 40.
- (en) N. Xu et M. Henkemeyer, « Ephrin-B3 reverse signaling through Grb4 and cytoskeletal regulators mediates axon pruning », Nature Neuroscience, vol. 12, , p. 268–276 (PMID 19182796, PMCID 2661084, DOI 10.1038/nn.2254).
- (en) Lei Shi, « Dock protein family in brain development and neurological disease », Communicative & Integrative Biology, vol. 6, no 6, (DOI 10.4161/cib.26839, lire en ligne, consulté le ).
- Alexandre Moreau, « III. Rôle de l’interaction Nck2/PAK3 dans la modulation de la transmission synaptique excitatrice : contrôle sérotoninergique de la balance excitation-inhibition dans le cortex visuel. », dans Alexandre Moreau, Neuromodulation des réseaux neuronaux, Université Paris-Sud, (lire en ligne [PDF]), pages 157 à 180.
- (en) Inji Park et Hyun-Shik Lee, « EphB/ephrinB Signaling in Cell Adhesion and Migration », Mol Cells, (PMCID PMC4314128, DOI 10.14348/molcells.2015.2116, lire en ligne, consulté le ).
- (en) D.L. Bishop, T. Misgeld, MK. Walsh, W.B. Gan et J.W. Lichtman, « Axon Branch Removal at Developing Synapses by Axosome Shedding », Neuron, vol. 44, no 4, , p. 651–661 (PMID 15541313, DOI 10.1016/j.neuron.2004.10.026).
- Serafino Malaguarnera, « Amnésie infantile », dans Serafino Malaguarnera, Dictionnaire de neuropsychanalyse, CreateSpace Independent Publishing Platform, , 492 p. (lire en ligne), page 23.
- (en) Society for Neuroscience, « Teen brain vulnerability exposed », sur Brain facts, (consulté le )
- Dalery 2012, p. 202.
- Fossati 2015, p. 92 à 94.
- Benjamin Rolland, Mécanismes dopaminergiques des symptômes schizophréniques et nouvelles perspectives de modulation thérapeutique., Université du Droit et de la Santé, , 128 p. (lire en ligne [PDF]), pages 39 à 49.
- Uta Frith, « Chapitre 11 - Le cerveau vu au scanner », dans Uta Frith, L' Énigme de l'autisme, Odile Jacob, , 368 p. (lire en ligne), page 196.
- Marie-Hélène Plumet, « 2 - Modèles mettant l'accent sur des (dys)fonctionnements ou biais cognitifs plus généraux (à répercussions dans le domaine social mais aussi non-social) », dans Marie-Hélène Plumet, L'autisme de l'enfant : Un développement sociocognitif différent, Armand Colin, , 264 p. (lire en ligne), pages 136 à 138.
- (en) Jacob A. Burack (dir.), « Ecological Theory of autism », dans Jacob A Burack ,Tony Charman, Nurit Yirmiya et Philip R. Zelazo, The Development of Autism : Perspectives From Theory and Research, Routledge, , 392 p. (lire en ligne), page 26.
- (en) Hansen Wang et Laurie C. Doering, Neural and Synaptic Defects in Autism Spectrum Disorders, Frontiers Media SA, (lire en ligne), pages 7 à 14.
- (en) Tom Guomei et al., « Loss of mTOR-Dependent Macroautophagy Causes Autistic-like Synaptic Pruning Déficits », Cell press sélections, Elsevier, vol. 83, no 5, (DOI https://dx.doi.org/10.1016/j.neuron.2014.07.040, lire en ligne, consulté le ).
Pour approfondir
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- (en) Deborah Sandoval, « Synaptic pruning mechanisms in learning », Independant Work Report, (lire en ligne [PDF], consulté le ).

- (en) William Damon, Richard M. Lerner, Deanna Kuhn et Robert S. Siegler, « Brain development and neural plasticity : A précis to brain development », dans William Damon, Richard M. Lerner, Deanna Kuhn et Robert S. Siegler, Handbook of Child Psychology, Cognition, Perception, and Language, John Wiley & Sons, , 1072 p. (lire en ligne).

- (en) Laura Freberg, « Chapter 5 - Genetics and the development of the human brain », dans Laura Freberg, Discovering Biological Psychology, Cengage Learning, , 608 p. (lire en ligne).
- (en) Greg Lemke, Developmental Neurobiology, Academic Press, , 771 p. (lire en ligne).
- (en) Robert Malenka, Intercellular Communication in the Nervous System, Academic Press, (lire en ligne).
- (en) James M. Bower (dir.), Computational Neuroscience : Trends in Research, 1999, Elsevier, , 1090 p. (lire en ligne).

- (en) Gal Chechik et Isaac Meiljison, « Neuronal Regulation Implements Efficient Synaptic Pruning », dans Michael S. Kearns, Michael J. Kearns, Sara A. Solla et David A. Cohn, Advances in Neural Information Processing Systems 11 : Proceedings of the 1998 Conference, MIT press, 1090 p. (lire en ligne), pages 95 à fin chapitre.

- Serafino Malaguarnera, Dictionnaire de neuropsychanalyse, CreateSpace Independent Publishing Platform, , 492 p. (lire en ligne).

- Jean Dalery (dir.) et al., « Aspects cliniques : Les effets à l'adolescence », dans Jean Dalery et al., Pathologies schizophréniques, Paris, Lavoisier, coll. « Médecine sciences publications », (lire en ligne), page 202.

- John T. Bruer, Tout est-il joué avant trois ans ? : les premiers stades du développement du cerveau et l'apprentissage tout au long de la vie, Odile Jacob, , 301 p. (lire en ligne), pages 130.
- Céline Alvarez et Catherine Meyer (dir.), « Le quotidien de l'enfant structure son cerveau », dans Céline Alvarez et Catherine Meyer, Les Lois naturelles de l'enfant : La Révolution de l'éducation, Les Arènes, , 452 p. (lire en ligne).
- Philippe Fossati, Imagerie cérébrale en psychiatrie : Contributions physiopathologiques de la neuro-imagerie, Lavoisier, , 304 p. (lire en ligne), pages 92 à 94.

- Frances E. Jensen et Amy Ellis Nutt, Le cerveau adolescent, JC Lattès, , 250 p. (lire en ligne).

- Barabara Ischinger et al., Comprendre le cerveau : Naissance d'une science de l'apprentissage, OECD Publishing, , 278 p. (lire en ligne), page 41.

- Pierre-André Doudin et Eric Tardif, Neurosciences et cognition : Perspectives pour les sciences de l'éducation, De Boeck Superieur, , 416 p. (lire en ligne).

Articles connexes
Liens externes
- Portail des neurosciences
- Portail de la psychologie
- Portail de la médecine


