Tomographie en cohérence optique
La tomographie en cohérence optique[1] ou tomographie optique cohérente (TCO ou (en) OCT) est une technique d'imagerie médicale bien établie qui utilise une onde lumineuse pour capturer des images tridimensionnelles d'un matériau qui diffuse la lumière (par exemple un tissu biologique), avec une résolution de l'ordre du micromètre (1 µm). La tomographie en cohérence optique est basée sur une technique interférométrique à faible cohérence, utilisant habituellement une lumière dans l'infrarouge proche. En effet, l'absorption de lumière des tissus biologiques imagés est limitée dans cette gamme de longueur d'onde, ce qui permet de pénétrer jusqu'à environ 1 mm. Cette technique se situe ainsi à mi-chemin entre l'échographie par ultrasons (résolution 150 µm, pénétration 10 cm) et la microscopie confocale (résolution 0,5 µm, pénétration 200 µm).

Suivant les propriétés de la source lumineuse (des diodes superluminescentes (en), des lasers à impulsions ultracourtes (en) et des lasers à supercontinuum ont été utilisés), la tomographie en cohérence optique atteint une résolution inférieure au micromètre (avec des sources d'émission à spectre très large au-dessus de la gamme des 100 nm de longueur d'onde.
La tomographie en cohérence optique (OCT) est une des sortes de techniques de tomographie optique. Mise en œuvre relativement récemment, la tomographie en cohérence optique dans le domaine fréquentiel procure comme avantages un meilleur rapport signal sur bruit, donnant une acquisition du signal plus rapide. Les systèmes disponibles dans le commerce sont employés dans diverses applications, dont les médecines conservatrices et de diagnostic, notamment en ophtalmologie où elle peut être utilisée pour obtenir des images détaillées de l'intérieur de la rétine. En 2009, elle a aussi commencé à être utilisée en cardiologie pour aider à diagnostiquer une maladie coronarienne[2].
Introduction

L’imagerie des tissus biologiques, en particulier de l’œil humain, a été le travail de beaucoup de groupes de recherche dans le monde. Débutant avec l’interférométrie en lumière blanche pour des mesures oculaires sur l’œil «in vivo»[3],[4], la première image “in vivo” du fond d’œil humain selon une coupe méridionale a été présentée pour la première fois à la conférence ICO-15 SAT en 1990[5].
Développée plus en détail pendant l’année 1990 par Naohiro Tanno[6],[7] , alors professeur à Yamagata University, et en particulier depuis 1991 par Huang et al., dans le laboratoire du Prof. James Fujimoto (en) du Massachusetts Institute of Technology (MIT)[8] , l’OCT apportant une résolution micrométrique et une capacité d'imagerie transversale est devenue une technique prédominante en recherche biomédicale. Elle est particulièrement bien adaptée aux applications ophtalmiques et a l’imagerie des tissus qui nécessitent une résolution micrométrique et une pénétration sur plusieurs millimètres de profondeur [9].
Les premières images OCT "in vivo" (traitant de structures rétiniennes) – ont été publiées en 1993, il faudra attendre 1997 pour les premières images endoscopiques[10],[11].
L’OCT a aussi été utilisé pour de nombreux cas de restauration-conservation d’objets d’art, où sont analysées différentes couches de peinture sur une toile. Cette particularité de pouvoir imager plusieurs couches en profondeur donne à cette technique un gros avantage par rapport à d’autres techniques d’imagerie biomédicale.
L’Échographie ultra-sonore, l’Imagerie par résonance magnétique (IRM), la Microscopie confocale et l’OCT ont tous des caractéristiques différentes pour l’imagerie des tissus biologiques : les deux premières techniques peuvent imager le corps humain entier mais sont limités en résolution (typiquement au millimètre), tandis que la troisième permet d’atteindre des résolutions sub-micrométriques mais ne pénètre que sur des centaines de micromètre au maximum. L’OCT est donc une technique complémentaire de celles-ci puisqu’elle pénètre sur quelques centimètres et a une résolution pouvant atteindre 20 micromètres (endocopie) voire 10 micromètres en latéral (ophtalmologie))[12],[13].
L’OCT est basée sur l’Interférométrie à faible cohérence[14],[15],[4]. Dans l’Interférométrie conventionnelle, c’est-à-dire avec une grande longueur de cohérence, les interférences ont lieu sur plusieurs mètres (par exemple avec des lasers continus). En OCT, ces interférences sont réduites à une distance de quelques micromètres grâce à l’utilisation de sources lumineuses large-bande (i.e. des sources ayant un spectre large, avec beaucoup de couleurs différentes). Ces sources peuvent être des diodes superluminescentes (en) ou des lasers à impulsions ultracourtes (en). Si une puissance plus faible suffit, une lumière blanche peut aussi être utilisée.
La lumière dans un système OCT est divisée sur 2 bras : un bras échantillon (qui contient l’objet que l’on veut imager), et un bras de référence (le plus souvent un miroir). La combinaison de la lumière réfléchie par l’échantillon et de celle provenant de la référence donne lieu à des interférences, mais seulement si la lumière a parcouru la même distance dans chacun des bras, à une longueur de cohérence près. En balayant le miroir de bras de référence, un profil de réflectivité de l’échantillon peut être obtenu (c’est de l’OCT temporel). Les parties de l’échantillon qui retro-réfléchissent beaucoup de lumière donneront plus d’interférence que les autres, créant ainsi un contraste. Toute lumière réfléchie à partir d’un autre plan en profondeur dans l’échantillon aura parcouru une distance trop grande (supérieure à la longueur de cohérence de la source) et n’interfèrera pas[16].
Ce profil de réflectivité, appelé A-scan (en), contient une information sur la structure et les dimensions spatiales de l’échantillon étudié. Une tomographie transverse (B-scan (en)) peut être realisée en combinant latéralement une série de ces profils A-scan (en). Une image « en-face » d’une certaine profondeur est possible dépendamment de la machine utilisée.
Explication
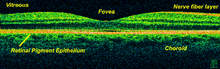
La tomographie en cohérence optique (OCT) est une technique permettant d’obtenir des images en profondeur de matériaux opaques ou transparents avec une résolution proche d’un microscope optique. C’est l’équivalent d’une « échographie optique », qui image de la lumière réfléchie provenant du matériau pour réaliser des coupes transverses[17].
L’OCT a attiré l’intérêt de la communauté médicale car elle permet d’imager la morphologie d’un tissu avec une résolution bien meilleure (en-dessous de 10 µm) que les autres techniques d’imagerie médicale conventionnelles (IRM, échographie …).
Les caractéristiques clés de l’OCT sont :
- Imagerie en temps réel de zones peu profondes avec une résolution proche du micrométrique
- Imagerie directe et instantanée de la morphologie du tissu biologique
- Aucune préparation préalable de l’échantillon imagé
- Pas de rayonnements ionisants (comme en rayons X par exemple)
L’OCT permet une haute résolution car elle utilise de la lumière plutôt que des sons ou des radiofréquences. Un faisceau optique est dirigé sur l’échantillon, et une petite portion de la lumière qui est réfléchie par une des couches du matériau est collectée. On peut remarquer que la plupart de la lumière réfléchie n’est pas collectée (elle est donc perdue), car elle est diffusée (« scattering » en anglais) dans de nombreuses directions. Il y a aussi de la lumière collectée parasite, car elle provient de la diffusion d’une zone de l’échantillon extérieure à la zone imagée. Cependant l’OCT utilise une technique interférométrique pour mesurer le chemin que la lumière reçue a parcouru depuis sa réflexion sur l’échantillon, et peut ainsi rejeter la majorité des photons qui sont diffusés de façon multiple avant d’être détectés. L’OCT permet ainsi de reconstruire des images 3D d’échantillon relativement épais en rejetant la lumière parasite lorsqu’une surface d’intérêt est imagée.
Parmi l’ensemble des techniques d’imagerie médicale 3D, l’OCT est à ranger parmi les techniques utilisant le phénomène d’écho (comme l’échographie par ultrasons). D’autres techniques comme la tomodensitométrie (ou scanner), l’IRM ou la tomographie par émission de positons n’utilisent pas ce phénomène[18]. Cette technique est limitée pour des images de 1 à 2 mm sous la surface de tissus biologiques, car au-delà la proportion de signal détecté est trop faible. Aucune préparation de l’échantillon n’est requise, et des images « sans contact » ou à travers une fenêtre transparente peuvent être réalisées. On peut aussi noter que le laser (ou la lumière peu cohérente) utilisée a une puissance relativement faible : elle est sans danger pour l’œil et ne provoque pas de dégâts sur l’échantillon.
Théorie
Le principe de l’OCT est celui de l’interférométrie en lumière blanche (et de l’interférométrie à faible cohérence). Le montage optique consiste en un interféromètre (Fig. 1, typiquement un interféromètre de Michelson) éclairé par une lumière à spectre large, à faible cohérence. La lumière est divisée (puis recombinée) en deux bras : référence et échantillon, respectivement.
 Fig. 1 OCT plein champ. Composants : diode super-luminescente (SLD), lentille convexe (L1), séparatrice 50/50 (BS), objectif de la caméra (CO), caméra CMOS-DSP (CAM), référence (REF) et échantillon (SMP). La caméra fonctionne comme un détecteur 2D, et à l’aide du scan en profondeur que permet l’OCT, une image 3D peut être recombinée. |
|
Fig. 3 Détermination spectrale par OCT à source de balayage, OCT fréquentielle (ou dans le domaine de Fourier) encodée dans le temps (TE-FD-OCT) . Composants : source laser à balayage de fréquence ou laser modulable en longueur d’onde (SS), séparatrice 50/50 (BS), référence (REF) et échantillon (SMP), photodétecteur (PD) et analyseur de données numérique (DSP) |
OCT temporelle (TD-OCT)
En OCT temporelle, la différence de marche du bras de référence varie dans le temps (le miroir de référence est translaté longitudinalement). En interférométrie à faible cohérence, les interférences i.e. des séries de franges brillantes et sombres, ont lieu seulement lorsque la différence de marche entre les 2 bras de l’interféromètre est plus petite que la longueur de cohérence de la source lumineuse. Cette interférence est appelée autocorrélation dans le cas où l’interféromètre est symétrique (les 2 bras ont la même réflectivité) ou corrélation croisée sinon. L’enveloppe de cette modulation varie avec la différence de marche, le maximum de l’enveloppe correspondant à l’égalité des chemins optiques (contact optique). L’interférence de deux faisceaux partiellement cohérents peut être exprimée en termes d’intensités lumineuses , comme :
où représente le rapport de division (d’intensité) du faisceau, et est appelé le degré de cohérence complexe, i.e. l’enveloppe et porteuse de l’interférence qui dépend du scan sur le bras de référence ou du délai , et dont la mesure est le but de l’OCT. Dû à l’effet de verrouillage de cohérence de l’OCT, le degré de cohérence complexe est représenté par une fonction gaussienne exprimée par [4]
où représente la largeur spectrale de la source dans le domaine fréquentiel, et est la fréquence centrale de la source. Dans l’équation (2), l’enveloppe gaussienne est modulée en amplitude par une porteuse optique. Le maximum de cette enveloppe représente la position de l’échantillon imagé, avec une amplitude dépendente de la réflectivité de la surface. La porteuse optique est due à l’effet doppler résultant du scan d’un bras de l’interféromètre, et la fréquence de modulation dépend de la vitesse du scan. Ainsi, translater un des bras de l’interféromètre a deux effets : le scan en profondeur et un décalage Doppler de la porteuse optique. En OCT, le décalage Doppler de la porteuse optique est exprimé par
où est la fréquence optique centrale de la source, est la vitesse de balayage (scan) de la différence de marche, et est la vitesse de la lumière.

Les résolutions latérale et axiale en OCT sont indépendantes l’une de l’autre : la première dépendant des optiques du montage et la seconde étant fonction de la longueur de cohérence de la source lumineuse. La résolution axiale en OCT est définie par :
où et sont respectivement la longueur d’onde centrale et la largeur spectrale de la source lumineuse[19].
OCT fréquentielle (FD-OCT)
En OCT fréquentielle (ou OCT dans le domaine de Fourier), (FD-OCT) les interférences large-bande sont enregistrées avec des détecteurs séparateurs de spectre (soit en encodant la fréquence optique dans le temps avec une source à balayage de fréquence, ou avec un détecteur à dispersion, comme un réseau de diffraction ou un détecteur 2D linéaire). Grâce à la relation de Fourier (théorème de Wiener-Khintchine) qui relie l’autocorrélation et la densité spectrale de puissance), la profondeur peut être immédiatement calculée par une transformée de Fourier depuis le spectre enregistré, sans aucun mouvement du bras de référence [20],[21]. Cet effet accélère grandement la vitesse d’imagerie, tandis que la réduction des pertes améliore grandement le rapport signal-sur-bruit proportionnel au nombre d’éléments de détection. La détection parallèle de plusieurs plages de longueurs d’onde limite l’intervalle de balayage, tandis que la largeur de bande spectrale dicte la résolution axiale[22].
Encodée spatialement
L’OCT fréquentielle encodée spatialement (SEFD-OCT en anglais, pour spectrally encoded Fourier domain OCT) réalise une mesure spectrale en répartissant, à l’aide d’un élément dispersif, différentes fréquences optiques sur les bandes d’un détecteur (un capteur CMOS ou CCD 2D divisé en lignes), voir Fig.4 ci-dessus. Ainsi l’information de tout le balayage en profondeur peut être acquis en une seule exposition. Cependant, le grand rapport signal sur bruit qui caractérise normalement la FD-OCT est réduit par la plus petite plage dynamique des détecteurs à bandes, comparés aux diodes photosensibles uniques : cela résulte en un SNR (rapport signal sur bruit) plus bas de ~10 dB aux vitesses élevées. Cela n’est pas problématique lorsqu’on travaille à la longueur d’onde de 1300nm, puisqu’une plage dynamique faible n’est pas un problème dans cette gamme de longueur d’onde[19].
En plus du plus faible SNR (rapport signal sur bruit), cette technique implique aussi une réduction en sinus cardinal (sinc) de la résolution en profondeur, due à la limitation de la bande de détection (un pixel détecte une portion quasi-rectangulaire d’une plage de longueur d’onde au lieu d’une fréquence bien précise, conduisant à un sinus cardinal (sinc(z)) sur la transformée de Fourier). De plus, dans la plupart des cas, les éléments dispersifs dans le détecteur spectral ne distribuent pas la lumière sur le détecteur avec des fréquences réparties de façon égales, même si les plus récents ont une dépendance inverse. Par conséquent le signal doit être re-échantillonné avant d’être traité, et ce processus ne peut prendre en compte des différences de largeur de bande locales (dépendantes d’un pixel à l’autre), ce qui résulte en une plus grande dégradation de la qualité du signal. Cette dégradation n’est cependant plus un problème avec le développement des nouvelles générations de capteurs CCD ou assemblage de photodiodes qui ont un nombre de pixels bien supérieur.
La détection optique hétérodyne (en) offre une autre approche à ce problème sans la nécessité d’une grande dispersion.
Encodée dans le temps
L’OCT fréquentielle encodée dans le temps (TEFD-OCT pour time-encoded Fourier-domain OCT en anglais , ou OCT à source à balayage, swept-source OCT en anglais) tente de combiner certains avantages de l’OCT standard et de la FD-OCT encodée spatialement. Ici les composantes spectrales ne sont pas encodées dans par une séparation spatiale, mais temporellement. Le spectre est soit généré soit filtré par des pas successifs en fréquences, puis reconstruit avant de subir la transformée de Fourier. En associant une source lumineuse à balayage de fréquence, la source optique devient plus simple que celle de la FD-OCT encodée spatialement, mais le problème du balayage qui était, dans le cas de la TD-OCT, essentiellement dans le bras de référence se retrouve maintenant dans la source lumineuse de la FD-OCT encodée temporellement. Ici l’avantage repose dans la technologie de haut SNR (rapport signal sur bruit), tandis que les sources à balayage atteignent des largeurs de bande instantanée très petites à des fréquences très élevées (20-200 kHz). Les désavantages sont la non-linéarité en longueur d’onde (surtout aux hautes fréquences), l’élargissement de la largeur de bande aux hautes fréquences et une haute sensibilité aux éléments de balayage de l’échantillon.
OCT plein champ (FF-OCT)
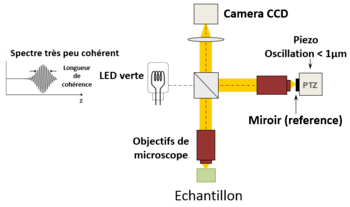
Une approche alternative de l'OCT temporelle et fréquentielle a été développée par l'équipe de Claude Boccara en 1998 [23], avec une acquisition des images sans balayage de faisceau. Dans cette technique appelée OCT plein champ (full-field OCT, FF-OCT), contrairement à d'autres techniques OCT qui acquièrent des sections transversales de l'échantillon, les images sont ici "en face", comme des images de microscopie classique: orthogonales au faisceau lumineux d'illumination [24].
Plus précisément, les images interférométriques sont créées par un interféromètre de Michelson où la différence de marche optique est balayée par un composant électrique rapide (habituellement un miroir piézoélectrique dans le bras de référence). Ces images acquises par une caméra CCD sont combinées en post-traitement (ou en direct) par la méthode de déphasage interférometrique, où habituellement 2 ou 4 images par période de modulation sont acquises selon l'algorithme utilisé [25], [26].
Les images tomographiques «en face» sont ainsi produites par un éclairage à champ large, assuré par la configuration Linnik de l'interféromètre de Michelson où un objectif de microscope est utilisé dans les deux bras. En outre, alors que la cohérence temporelle de la source doit rester faible comme dans les OCT classiques (c'est-à-dire un large spectre), la cohérence spatiale doit également être faible pour éviter les interférences parasites (c'est-à-dire une source de grande taille) [27].
Quelques applications
La tomographie par cohérence optique est une technique d'imagerie médicale bien établie, et est utilisée dans plusieurs spécialités médicales dont l'ophtalmologie et la cardiologie, en plus d’être largement utilisée dans la recherche biomédicale.
Soin des yeux
L'OCT est très utilisée par les ophtalmologistes et les optométristes pour obtenir des images à haute résolution du segment antérieur de l’ œil humain et de la rétine. A l’aide de son pouvoir de résolution transverse, l’OCT fournit une méthode simple d'évaluation de l'intégrité axonale dans les cas de sclérose en plaques [28] et de glaucome[29]. L'OCT est également bien adaptée pour évaluer la dégénérescence maculaire liée à l'âge [30] et est considéré comme la nouvelle norme pour l'évaluation de l’état d’un œdème maculaire diabétique [31]. Plus récemment, des dispositifs OCT ophtalmiques ont été conçus pour effectuer des angiographies ou pour évaluer des pathologies de la microvasculature de la rétine, impliquées dans des maladies telles que le glaucome et la rétinopathie diabétique.
Cardiologie
Dans le cadre de la cardiologie, l’OCT est utilisée pour imager des artères coronaires, afin de visualiser la morphologie et la microstructure des vaisseaux à une résolution 10 fois supérieure à d'autres modalités existantes telles que les ultrasons intravasculaires et l'angiographie par rayons X ([Tomographie Intracoronaire par cohérence optique]]). Pour ce type d'application, des cathéters à fibres optiques d'environ 1 millimètre de diamètre sont utilisés pour accéder à la lumière de l'artère à travers des interventions semi-invasives, c'est-à-dire une intervention coronaire percutanée. La première réalisation de l'OCT endoscopique a été rapportée en 1997 par des chercheurs du laboratoire James Fujimoto du Massachusetts Institute of Technology, dont le Prof. [Guillermo James Tearney] et le Prof. [Brett Bouma][32]. Le premier cathéter et système d'imagerie TD-OCT a été commercialisé par LightLab Imaging, Inc., une société créée au Massachusetts en 2006. La première étude d'imagerie FD-OCT a été rapportée par le laboratoire du Prof. Guillermo James Tearney et le Prof. Brett Bouma basé à Massachusetts General Hospital en 200 8[33]. La FD-OCT intravasculaire a été introduite pour la première fois sur le marché en 2009 par LightLab Imaging, Inc. [34] et Terumo Corporation a lancé une deuxième solution pour l'imagerie de l'artère coronaire en 2012. La FD-OCT permettant une vitesse d'imagerie plus élevée, elle a été largement adoptée pour l'imagerie de l'artère coronaire. On estime que> 100 000 cas d'imagerie coronaire FD-OCT sont effectués chaque année, et que le marché augmente d'environ 20% annuellement [35].
Oncologie
L’OCT endoscopique a été appliquée à la détection et au diagnostic de cancer et de lésions précancéreuses, telles que l'œsophage de Barrett et la dysplasie oesophagienne[36].
Voir aussi
- Interférométrie
- Tomographie par projection optique (en)
- Tomographie
- Microscope confocal
- Imagerie médicale
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Optical_coherence_tomography » (voir la liste des auteurs).
- Même si on rencontre beaucoup « par » ou « de » à la place de « en », le dictionnaire de l'Académie de médecine française utilise « en ».
- (en) Bezerra, Hiram G.; Costa, Marco A.; Guagliumi, Giulio; Rollins, Andrew M.; Simon, Daniel I. (novembre 2009). "Intracoronary Optical Coherence Tomography: A Comprehensive Review". JACC: Cardiovascular Interventions 2 (11): 1035–1046. doi:10.1016/j.jcin.2009.06.019. PMID 19926041.
- (en) A.F. Fercher et E. Roth, « Ophthalmic laser interferometry », Proc. SPIE, vol. 658, , p. 48–51 (DOI 10.1117/12.938523)
- (en) A. F. Fercher, K. Mengedoht et W. Werner, « Eye-length measurement by interferometry with partially coherent light », Optics Letters, vol. 13, no 3, , p. 186–8 (PMID 19742022, DOI 10.1364/OL.13.000186, Bibcode 1988OptL...13..186F)
- (en) A.F. Fercher (12–16 August 1990) « Ophthalmic interferometry » : 221–228 p..
- Naohiro Tanno, Tsutomu Ichikawa, Akio Saeki: "Lightwave Reflection Measurement", Japanese Patent # 2010042 (1990) (Japanese Language)
- (ja) (1991) « Backscattering Optical Heterodyne Tomography » dans 14th Laser Sensing Symposium .
- (en) D Huang, EA Swanson, CP Lin, JS Schuman, WG Stinson, W Chang, MR Hee, T Flotte, K Gregory, C. Puliafito et al. Et, « Optical coherence tomography », Science, vol. 254, no 5035, , p. 1178–81 (PMID 1957169, PMCID 4638169, DOI 10.1126/science.1957169, Bibcode 1991Sci...254.1178H)
- (en) AM Zysk, FT Nguyen, AL Oldenburg, DL Marks et SA Boppart, « Optical coherence tomography: a review of clinical development from bench to bedside. », Journal of biomedical optics, vol. 12, no 5, , p. 051403 (PMID 17994864, DOI 10.1117/1.2793736, Bibcode 2007JBO....12e1403Z)
- (en) A.F. Fercher, C.K. Hitzenberger, W. Drexler, G. Kamp et H. Sattmann, « In Vivo Optical Coherence Tomography », American Journal of Ophthalmology, vol. 116, no 1, , p. 113–114 (PMID 8328536, DOI 10.1016/S0002-9394(14)71762-3)
- (en) E. A. Swanson, J. A. Izatt, M. R. Hee, D. Huang, C. P. Lin, J. S. Schuman, C. A. Puliafito et J. G. Fujimoto, « In vivo retinal imaging by optical coherence tomography », Optics Letters, vol. 18, no 21, , p. 1864–6 (PMID 19829430, DOI 10.1364/OL.18.001864, Bibcode 1993OptL...18.1864S)
- (en) Wolfgang Drexler, Uwe Morgner, Ravi K. Ghanta, Franz X. Kärtner, Joel S. Schuman et James G. Fujimoto, « Ultrahigh-resolution ophthalmic optical coherence tomography », Nature Medicine, vol. 7, no 4, , p. 502–7 (PMID 11283681, PMCID 1950821, DOI 10.1038/86589)
- (en) S Kaufman, DC Musch, MW Belin, EJ Cohen, DM Meisler, WJ Reinhart, IJ Udell et WS Van Meter, « Confocal microscopy: A report by the American Academy of Ophthalmology », Ophthalmology, vol. 111, no 2, , p. 396–406 (PMID 15019397, DOI 10.1016/j.ophtha.2003.12.002)
- (en) S.J. Riederer, « Current technical development of magnetic resonance imaging », IEEE Engineering in Medicine and Biology Magazine, vol. 19, no 5, , p. 34–41 (PMID 11016028, DOI 10.1109/51.870229)
- (en) M. Born et E. Wolf, Principles of Optics: Electromagnetic Theory of Propagation, Interference, and Diffraction of Light, Cambridge University Press, (ISBN 0-521-78449-2, lire en ligne)
- (en) JG Fujimoto, C. Pitris, SA Boppart et ME Brezinski, « Optical Coherence Tomography: An Emerging Technology for Biomedical Imaging and Optical Biopsy », Neoplasia, vol. 2, , p. 9-25 (PMCID PMC1531864)
- (en) Michelessi M, Lucenteforte E, Oddone F, Brazzelli M, Parravano M, Franchi S, Ng SM, Virgili G, « Optic nerve head and fibre layer imaging for diagnosing glaucoma », Cochrane Database Syst Rev, no 11, , CD008803 (PMID 26618332, DOI 10.1002/14651858.CD008803.pub2)
- (en) Unknown Unknown, « Optical Coherence Tomography provides better resolution than an MRI and Helps Diagnose Retina & Corneal Disease and Glaucoma, Part II », sur mastereyeassociates.com, mastereyeassociates, (consulté le 13 juin 2017)
- (en) A. Garg, Anterior & Posterior Segment OCT: Current Technology & Future Applications, 1st edition,
- (en) J.M. Schmitt, « Optical coherence tomography (OCT): a review », IEEE Journal of Selected Topics in Quantum Electronics, vol. 5, no 4, , p. 1205–1215 (DOI 10.1109/2944.796348)
- (en) A Fercher, C.K. Hitzenberger, G. Kamp et S.Y. El-Zaiat, « Measurement of intraocular distances by backscattering spectral interferometry », Optics Communications, vol. 117, , p. 43–48 (DOI 10.1016/0030-4018(95)00119-S, Bibcode 1995OptCo.117...43F)
- (en) Johannes F. de Boer, R. Leitgeb et M. Wojtkowski, « Twenty-five years of optical coherence tomography: the paradigm shift in sensitivity and speed provided by Fourier domain OCT », Biomed. Opt. Express, vol. 8, no 7, , p. 3248-3280 (DOI 10.1364/BOE.8.003248)
- (en) E. Beaurepaire et A.C. Boccara, « Full-field optical coherence microscopy », Optics Letter, vol. 23, no 4, , p. 244-246
- A. Dubois et A.C. Boccara, « L’OCT plein champ », Médecins/Sciences, vol. 22, no 10, , p. 859-864 (DOI 10.1051/medsci/20062210859)
- (en) A. Dubois, G Moneron et A.C. Boccara, « Thermal-light full-field optical coherence tomography in the 1.2 micron wavelength region », Optics Communications, vol. 266, , p. 738-743
- (en) A.C. Boccara, F. Harms et A. Latrive, « Full-field OCT: a non-invasive tool for diagnosis and tissue selection. », SPIE Newsroom, (DOI 10.1117/2.1201306.004933)
- (en) A.C. Boccara et A. Dubois, Optics in Instruments, , 101-123 p. (DOI 10.1002/9781118574386.ch3), « Optical Coherence Tomography »
- (en) Jan Dörr, K. D. Wernecke, M Bock, G Gaede, J. T. Wuerfel, C. F. Pfueller, J Bellmann-Strobl, A Libération, A. U. Brandt et P Friedemann, « Association of retinal and macular damage with brain atrophy in multiple sclerosis. », PLoS ONE, vol. 6, no 4, , e18132 (PMID 21494659, PMCID 3072966, DOI 10.1371/journal.pone.0018132, Bibcode 2011PLoSO ... 618132D, lire en ligne)

- (en) D. S. Grewal et A. P. Tanna, « Diagnosis of glaucoma and detection of glaucoma progression using spectral domain optical coherence tomography. », Current opinion in Ophthalmology, vol. 24, no 2, , p. 150-61 (PMID 23328662, DOI 10.1097 / ICU.0b013e32835d9e27)
- (en) P. A. Keane, P. J. Patel, S Liakopoulos, F. M. Heussen, S. R. Sadda et A Tufail, « Evaluation of age-related macular degeneration with optical coherence tomography », Survey of Ophthalmology, vol. 57, no 5, , p. 389-414 (PMID 22898648, DOI 10.1016)
- (en) G Virgili, F Menchini, G Casazza, R Hogg, R. R. Das, X Wang et M Micnuti, « Optical coherence tomography (OCT) for detection of macular oedema in patients with diabetic retinopathy », Cochrane Database Syst Rev, vol. 1, , CD008081 (PMID 25564068, PMCID 4438571, DOI 10.1002 / 14651858.CD008081.pub3)
- (en) G. J. Tearney, M. E. Brezinski, B. E. Bouma, S. A. Boppart, C Pitris, J. F. Southern et J. G. Fujimoto, « In vivo endoscopic optical biopsy with optical coherence tomography », Science, vol. 276, no 5321, , p. 2037–2039 (PMID 9197265, DOI 10.1126/science.276.5321.2037, http: //science.sciencemag.org/content/276/5321/2037.long)
- (en) G. J. Tearney, S Waxman, M Shishkov, B. J. Vakoc, M. J. Suter, M. I. Freilich, A. E. Desjardins, W. Y. Oh, L. A. Bartlett, M Rosenberg et B. E. Bouma, « Three-Dimensional Coronary Artery Microscopy by Intracoronary Optical Frequency Domain Imaging », JACC Cardiovascular imaging, vol. 1, no 6, , p. 752-761 (PMID 19356512, PMCID 2852244, DOI 10.1016 / j.jcmg.2008.06.007, lire en ligne)
- « LightLab launches FD-OCT in Europe » (consulté le 9 septembre 2016)
- Eric Swanson, « Optical Coherence Tomography: Beyond better clinical care: OCT's economic impact », (consulté le 9 septembre 2016)
- « Next-gen OCT for the esophagus », (consulté le 9 septembre 2016)
- Portail de la médecine
- Portail de l’optique
- Portail de l’imagerie numérique