Syndrome de Guam
Le syndrome de Guam (ou Lytigo-bodig ou Bodig ou en anglais : Lytico-Bodig disease ou ALS ou encore AL-SPDC pour « Amyotrophic lateral sclerosis/parkinsonism-dementia complex »[1] pour les anglophones), est une neuropathie chronique atypique (maladie neurologique chronique dégénérative), épidémique mais non-contagieuse, découverte dans l'Île de Guam, la plus grande des îles Mariannes (556,85 km2).
L'étiologie de cette maladie est longtemps restée mystérieuse. Elle affecte le système nerveux central et est responsable de troubles à la fois moteurs et mentaux, d'évolution progressive.

ou
« Amyotrophic lateral sclerosis / parkinsonism-dementia complex »
| CIM-10 | F02.3 |
|---|---|
| eMedicine | neuro/ |
![]()
Ce syndrome tire son nom du fait qu'au milieu du XXe siècle, les médecins et épidémiologistes américains ont constaté sur cette île - et uniquement là - une incidence anormalement élevée (50 à 100 fois plus que la normale) d'un syndrome évoquant des maladies neurodégénératives connues, mais avec des cas sporadiques parmi les jeunes.
Cette maladie, apparemment émergente n'était constatée qu'au sein de la population autochtone Chamorro[2], ce qui était très intriguant et préoccupant pour les épidémiologistes.
Elle a sévi durant presque un siècle puis a fortement régressé.
Symptômes
Ce syndrome mêle les symptômes d'une SLA (sclérose latérale amyotrophique, dite Amyotrophic lateral sclerosis ou « Lou Gehrig's disease » en Amérique du Nord) à ceux d'une démence parkinsonnienne, et de la maladie d'Alzheimer[3],[4] conduisant à une maladie neurodégénérative mortelle.
Sur l'île de Guam, la gamme des symptômes variait légèrement, mais évoquait fortement une SLA (sclérose latérale amyotrophique) et une démence parkinsonnienne, si ce n'est qu'ils apparaissaient plus tôt, entre 25 et 40 ans.
Beaucoup de victimes n'arrivaient plus à parler spontanément, tout en pouvant répondre de façon cohérente et fluide quand on leur parlait.
Le nom créole du syndrome Lytico-bodig évoque la double face de cette maladie, chacune étant plus ou moins développée selon les patients, avec de nombreuses variantes possibles :
- Lytico : paralysie progressive qui ressemble à la SLA (sclérose latérale amyotrophique), maladie neuronale ;
- Bodig : un syndrome parkinsonien correspondant à un état de démence occasionnelle.
Sacks a décrit comme suit les symptômes cliniques.
L'état de santé du patient se dégrade rapidement : en 18 mois, après des phases d'immobilité anormale, de pertes d'initiative et de spontanéité, la patient doit faire un énorme effort pour marcher, se tenir debout, puis pour faire le moindre mouvement, son corps étant comme désobéissant.
Après un an, il ne peut vivre seul ni contrôler la posture de son corps.
Ces symptômes sont souvent accompagnés d'une démence aphasique, agitée, caractérisée par des phases de comportement irrationnel, de violence avec émotions exacerbées et incontrôlables. Le patient peut d'une minute à l'autre passer d'un état gai avec rire, à celui d'une profonde colère, avec hurlements.
En phase aiguë, la mâchoire pend avec écoulement de salive, la parole et la déglutition étant impossibles. Bras et jambes se paralysent ou sont parcourus de spasmes sévères, se tordent et se tendent. Souvent le patient est prostré, avec une immobilité profonde, presque catatonique, accompagné de petits tremblements ou de rigidité de membres. La parole et la pensée lucide semblent impossibles, sauf dans certains cas de démence associée. Enfin, survient la mort.
Prévalence
Elle a fortement varié selon les décennies, avec un pic dans les années 1940 à 1950 pour retomber à un taux légèrement supérieur à la normale vers la fin des années 1980, sans différence entre hommes et femmes, alors que quelques années avant, les hommes étaient 2 à 3 fois plus touchés que les femmes, surtout pour ceux nés après 1920. Le taux de personnes touchées ont varié dans le temps, avec un risque variant selon que les patients habitaient au nord, au sud, à l'Est ou à l'ouest de l'île[5].
Histoire médicale

Découverte et antériorité
Le syndrome Lytico-bodig semble avoir été médicalement décrit sur l'île de Guam en 1952 par Koerner[6], puis confirmé un an plus tard par Arnold[7] à la suite de l'étude d'une situation épidémiologique tout à fait atypique [8]. Ces faits sont confirmés en 1953 par Tillema and Wijnberg[9], puis Kurland and Mulder[10],[11], puis par des médecins militaires nord-américains en 1954 (Mulder et al.[12]) qui estiment qu'il y a à Guam 50 à 100 fois plus de prévalence de la sclérose latérale amyotrophique que dans le reste du monde. Peu après, la même équipe confirme que cette épidémie est également accompagnée d'une augmentation notable de cas démences parkinsoniennes, toujours dans la population Chamorro[12].
En 1961, Hiranno & al. concluent à un syndrome unique[13],[14].
En remontant dans le temps, les premiers cas évoquant rétrospectivement ce syndrome sont issus de trois certificats de décès faisant mention d'une paralysie, datant de 1904, établis sur l'île de Guam.
Dans les années 1940-1950, la fréquence des cas a grandi parmi le peuple autochtone Chamorro jusqu'à devenir la principale cause de décès de 1940 à 1956. On pense d'abord à des causes génétiques[15], ou partiellement génétiques[16] et familiales[17], mais les bilans après 10 ans de suivi épidémiologique[18], une étude rétrospective sur 25 ans[19], puis un bilan à 40 ans[20], ne peuvent appuyer ni confirmer cette hypothèse.
En 1980, l'étude[21] de cas de 28 personnes ayant passé leur enfance et adolescence dans l'île puis ayant migré et déclaré ailleurs la maladie (de 1 à 34 ans après avoir quitté l'île) a montré que ce syndrome peut se manifester jusqu'à plus de 30 ans après le début de l'intoxication[4]. Ce phénomène rend encore plus difficile un suivi épidémiologique et il semble donc probable qu'on a sous-estimé le nombre de morts et de malades[21].
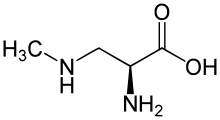
L'hypothèse du BMAA
Dans le cadre d'autres types d'études (écoépidémiologiques), il a été découvert que de grandes quantités de BMAA (neurotoxine connue comme étant produite par certaines bactéries) étaient présentes dans les graines et fruits d'un arbre local alors encore très présent, le Cicas ou Cycas (Cycas micronesica)[2], une plante arborescente ressemblant à un palmier. Cette plante fait partie d'une famille dont les fruits et graines sont consommés ailleurs dans le monde, mais qui comprend d'autres espèces connues pour produire des toxines (en Inde notamment).
Il a ensuite été démontré que ce BMAA était en réalité produit par des milliers de petites colonies vertes de cyanobactéries symbiotiques, chacune étant abritée dans un nodule produit par les cicas et les cyanobactéries, dans des racines spécialisées dites « racines coralloïdes »[2],[22].
Diverses analyses ont montré que sous forme libre dans la nature, ces cyanobactéries ne contiennent qu'environ 0,3 microg/g de BMAA, alors qu'en relation symbiotique avec leur arbre (cicas), elle en produisent jusqu'à 120 fois plus (2 à 37 microg/g)[23].
Ce BMAA est transporté par la sève des racines vers les branches, puis concentré dans les tissus reproducteurs (ovules, puis fruits et graines notamment) : 9 microg/g en moyenne dans la partie charnue du sarcotest et plus de 100 fois plus, 1 161 microg/g en moyenne, dans l'enveloppe périphérique de la graine[23].
Ce BMAA est trouvé sous deux formes dans le fruit et la graine[2]: 1) en très faible quantité sous forme libre ; 2) sous forme liée à des protéines.
Des chercheurs ont suggéré un lien entre ce BMAA et l'étrange syndrome de Guam [24] , sans toutefois pouvoir le démontrer[25]. Mais l'hypothèse est apparue trop peu crédible car il faudrait ingérer des tonnes de farines de graines ou de fruits du cicas pour accumuler la quantité de BMAA trouvée dans le cerveau de certains malades. Pour cette raison la piste de la neurotoxine bactérienne a été abandonnée et durant une trentaine d'années les recherches furent orientées vers d'autres explications dont aucune n'a été convaincante.
Plusieurs décennies après (fin du XXe siècle), certains chercheurs rénovent l'hypothèse de la toxine en montrant que plusieurs espèces d'animaux mangés par l'Homme se nourrissent du fruit et de la graine du cicas et bio-accumulent la toxine dans leurs tissus gras. C'est le cas des roussettes (Pteropus mariannus), des cochons et des cervidés. Cette roussette a actuellement disparu de l'île à la suite d'une chasse intensive par la population locale, mais elle a été très consommée au début du XXe siècle. Elle était très prisée du peuple autochtone Chamorro qui la chassait et la mangeait traditionnellement bouillie dans une crème de coco.
La teneur en BMAA de la chair de ces animaux (3 556 microg/g en moyenne) montre qu'ils ont largement pu participer à une rapide bioamplification de la neurotoxine dans le réseau trophiques local ; jusqu'à l'Homme, qui est situé à la fin de la chaîne alimentaire[23]).
Il a ensuite été montré que le BMAA est une toxine liposoluble, résistante à la chaleur d'une cuisson, et assez stable pour qu'on la retrouve en quantité élevée dans les roussettes de Guam conservées dans les musées[26]. La consommation d'une seule roussette apporte une dose de BMAA équivalente à 174 kg à 1,014 tonnes de farine de cycas[26]. À cause des festins traditionnels de renards volants (autre nom de cette roussette), les Chamorros mouraient nombreux du syndrome de Guam. Ce BMAA (lié à des protéines) a d'ailleurs aussi été retrouvé dans le cerveau des morts du syndrome de Guam (à des concentrations moyennes de 627 microg/g, 5 mM) alors qu'on ne l'a pas trouvé dans les cerveaux de cas-témoins, ni dans le cerveau de patients morts de maladie de Huntington[2].
Malgré un suivi épidémiologique plus attentif et de très rares cas similaires (pouvant aussi avoir une cause génétique[27]) dans les autres îles de la région, on ne trouve pas de situations comparables ailleurs.
Ces découvertes ont ravivé l'intérêt pour l'hypothèse que le BMAA pourrait être déclencheur possible d'autres maladies neurodégénératives, d'autant qu'il a aussi été trouvé (à des taux moyens de 95 microg/g, 0,8 mM) dans le cerveau d'individus nord-américains morts de maladie d'Alzheimer, ce qui renforce l'hypothèse d'un rôle étiologique possible du BMAA dans le cas de maladies neurodégénératives ailleurs que dans l'île[2],[23] (et une étude encore contestée laisse penser que d'autres plantes ou animaux pourraient concentrer le BMAA[4]).
Les cyanobactéries sont abondantes dans le monde entier. De plus, les pullulations de cyanophycées dans des réservoirs superficiels d'eau potable sont de plus fréquentes (en raison de déséquilibres écologiques encore mal compris, mais semblant impliquer l'eutrophisation des eaux de surface)[2].
L'hypothèse d'une carence en certains minéraux
Dans les années 2000, l'hypothèse de facteurs environnementaux jouant un rôle majeur dans le développement de maladies neurodégénératives gagne du terrain. Il pourrait s'agir de facteurs alimentaires classiques (liés à une carence en certains minéraux[28]). Les 3 foyers les plus touchés étaient des zones pauvres en calcium et magnésium[29] et de telles carences se montrent en laboratoire capables d'induire des neuropathies aux caractéristiques proches chez des singes Cynomolgus [29]. Pourtant il existe des carences de ce type en de nombreux endroits dans le monde, sans effets comparables à ceux observés sur l'île de Guam. Et l'hypothèse d'une carence due à l'environnement ne permet pas non plus d'expliquer pourquoi les générations précédentes semblaient indemnes.
Aujourd'hui
Certains auteurs[2],[30] évoquent la combinaison de 2 facteurs. D'une part une bio-accumulation de BMAA environnemental issu de certaines souches de cyanobactéries et impliqué dans la maladie d'Alzheimer, la SLA (Sclérose Latérale Amyotrophique)[31] ou la maladie de Parkinson[32]). Et d'autre part une incapacité à prévenir l'accumulation de protéines liées au BMAA dans le cerveau. Mais seule une prédisposition génétique a été constatée chez des patients. Ces hypothèses restent donc encore à confirmer (par exemple par tracage isotopique ou par des études épidémiologiques et écoépidémiologiques solides).
Le syndrome a fait l'objet d'un livre récent The Island of the Colorblind, écrit par un neurologue (Oliver Sacks)[33].
Étiologie
Le mécanisme de la maladie est complexe et encore mal compris.
Lors des autopsies, des dégénérescences neurofibrillaires étaient trouvées dans le cerveau, très semblables à celles trouvées dans le cerveau de malades d'Alzheimer, mais avec encore plus de dégénérescence neurofibrillaire.
Selon Sacks, dans la substantia nigra (ou substance noire, dite aussi locus niger, noyau du système nerveux situé au niveau du mésencéphale et du diencéphale sus-jacent) « Beaucoup de cellules sont pâles et dépigmentées. Il y a beaucoup de réactions gliales, et des amas de pigments en désordre. Au plus fort grossissement, on observe un grand nombre d'enchevêtrements neurofibrillaires, une coloration dense, des masses alambiquées, des lacunes dans les cellules nerveuses détruites ». En observant « d'autres échantillons du système nerveux (de l'hypothalamus, de moelle épinière ou du cortex), tous étaient pleins d'enchevêtrements neurofibrillaires. La dégénérescence neurofibrillaire était partout », en apparence, comme dans les tissus nerveux caractérisant le parkinsonisme post-encéphalitique, et aussi très similaire à la dégénérescence neurofibrillaire observée dans la maladie d'Alzheimer (bien qu'avec une distribution différente et des densités de dégénérescence différentes).
Ce processus de dégénérescence neurofibrillaire peut expliquer les symptômes, mais il reste encore beaucoup à découvrir sur les modalités causales de la dégénérescence, sur sa sévérité et progression. Étant donné les similitudes anatomopathologiques et de symptômes entre ces maladies, on s'est même demandé si le syndrome de Guam et la maladie d'Alzheimer, certains syndromes post-encéphalitiques ne seraient pas des variantes d'une même maladie, éventuellement virale.
L'âge d'apparition semblait augmenter, sans progression du nombre de cas chez les adolescentes et presque pas de cas dans la vingtaine, ce qui pourrait être rétrospectivement expliqué par la disparition des roussettes, et la diminution du nombre de cycas, mais il semble que parfois, une forme de la maladie dominait durant une décennie, puis l'autre dans la décennie suivante. Cependant ces variations n'ont pas été précisément comptabilisées, ce qui interdit une interprétation épidémiologique.
Traitement, soins
Aucun médicament efficace n'a jamais été trouvé pour traiter cette maladie.
De la L-DOPA a parfois été donnée aux patients pour soulager certains des symptômes, mais les patients ne bénéficiaient que de quelques heures d'amélioration de la paralysie complète et de la rigidité des membres.
Quand cette maladie est devenue la première cause de mortalité des Chamorro, ce sont les familles qui ont été les principaux pourvoyeurs de soins, généralement à domicile.
Évolutions de la recherche
Les hypothèses explorées par la recherche ont principalement porté sur 3 points :
- d'éventuelles prédispositions génétiques.
C'est la première piste à avoir été explorée, et la première à avoir été réfutée, aucun lien "mendéléien" ayant pu être trouvé entre la maladie, les individus et leurs familles. De plus aucun Chamorro ayant grandi hors de Guam n'a déclaré la maladie, alors que certains non-Chamorro ayant déménagé dans l'île et ayant adopté les habitudes culinaires traditionnelles l'ont développée[34]. - le rôle des semences et fruits des cycas et leurs teneurs en BMAA.
Alors que la plante était encore courante dans l'île, ses graines étaient traditionnellement broyées pour en faire une farine dite "fadang", utilisée pour faire des sortes de tortillas ou des boulettes. La farine était trempée et nettoyée plusieurs fois parce que naturellement extrêmement toxique (comme celles d'autres espèces du même genre) ; un article cité par Miller[25] décrit que le bétail buvant l'eau du premier lavage tombait « raide mort sur le coup ». Beaucoup de recherches ont été effectuées sur l'hypothèse que la population pouvait être empoisonnée par une farine mal lavée (la toxine supposément en cause, la cycasine, a été identifiée dans les années 1950), mais cette hypothèse n'a pu être confortée, d'autant que les générations précédentes de Chamorros qui mangeaient la même farine n'étaient victimes ni du poison violent, ni - a priori - du syndrome de Guam. De plus la cycasine est l'un des plus puissants cancérogènes connus à l'époque, et ce ne sont pas des cancers qui étaient observés, mais bien des problèmes neurologiques.
Dix ans plus tard, vers 1960, des biochimistes britanniques identifient une autre substance toxiques, la bêta-N-méthylamino-levoalanine ou BMAA. Et en faisant consommer cette toxine par des animaux de laboratoires (singes) ils constatent que ces singes développent effectivement les symptômes de la SLA-PDC et donc de lytico-bodig. Cependant, en analysant la farine préparée et consommée par les Chamorros, on n'y a jamais trouvé de BMAA en quantité suffisante pour induire la maladie chez les singes ou d'autres animaux.
- la contamination de la chaîne alimentaire via la consommation de viande de chauves-souris frugivores.
C'est la dernière hypothèse, et la plus plausible, proposée par Paul Alan Cox et Oliver Sacks après qu'ils ont examiné la chaîne alimentaire des Chamorros [3]. Ce n'est pas la farine, mais la viande de chauves-souris mangeant des graines de cycas qui serait en cause. On a constaté que les chauves-souris bioaccumulaient effectivement le BMAA dans leur graisse, et que manger ne serait-ce que quelques chauves-souris exposait à une dose de BMAA comparable à celle induisant les symptômes de maladie dans le modèle animal. Cox a aussi observé qu'après la diminution de consommation des chauves-souris frugivores, la maladie a régressé[35].
L'hypothèse actuellement la plus admise
C'est celle, confortée par un nombre croissant d'indices et de preuves, d'un facteur environnemental (toxine bioaccumulée).
Cette maladie atypique aurait au moins été en grande partie induite par une intoxication chronique par des neurotoxines bactériennes bioaccumulées par la chaine trophique, avec deux maillons essentiels qui sont 1) les fruits et graines d'une plante arborescente (un Cycas, Cycas micronesica plus exactement), et 2) le gibier ou les cochons nourris avec ces fruits.
La maladie (en nombre de nouveaux cas annuellement déclarés) a d'ailleurs fortement régressé dans les années 1980-1990, alors que les festins traditionnels de chauves-souris avaient cessé (la chauve-souris en cause ayant elle-même disparu, a priori victime de la surexploitation de ses populations par la chasse) et que les cycas ont eux-mêmes presque disparu dans l'île de Guam et les îles ou archipels proches (ce cycas est classé « espèce menacée »). D'autres auteurs pensent que l'arrivée de l'eau potabilisée pourrait aussi avoir joué un rôle dans le recul de la maladie.
Quelques éléments restent troublants, évoquant :
- une maladie émergente du XXe siècle, car rien dans la littérature sur l'histoire des Chamorros n'évoque quoi que ce soit ressemblant au syndrome de Guam avant le début du XXe siècle. Ce peuple était au contraire décrit comme très sain, et ses membres vivaient vieux. Ce n'est qu'à partir de 1904 que des morts par paralysie sont signalés, et des années 1940 à 1960, cette paralysie devient la première cause de décès des Chamorros adultes (voir graphique[36]).
- une possible conjonction entre des facteurs de risque génétiques propres à la population autochtone, et un ou plusieurs facteurs environnementaux ou comportementaux favorisant une vulnérabilité accrue à cette toxine (on a pensé à des séquelle de guerre car l'île a aussi souffert de la Seconde Guerre mondiale, aux sols naturellement riches en aluminium - il existe une mine de Bauxite sur l'île, et ce métal a été soupçonné de neurotoxicité…)
La piste d'une vulnérabilité génétique est plausible car la population de Guam a subi plusieurs événements graves dans la période historique récente. Les Chamorros réputés originaires de l'archipel malais seraient sur l'île depuis 1527 av. J.-C.[37] Leur première rencontre avec les européens est supposée dater de 1521, quand Magellan a débarqué près du village d'Umatac dans le sud de Guam. La population chamorro était alors évaluée à environ 50 000 personnes[38]. En 1668 les Chamorros ont été victimes d'un génocide (cause plausible d'un « goulot d'étranglement » en termes de diversité génétique dans la population) et en 1710 il ne restait presque pas de Chamorros sur l'île de Guam. Durant plus de deux siècles les Chamorros ont été victimes d'une guerre contre les Espagnols (1675-1693), de deux typhons (1621 et 1693), et aussi de maladies infectieuses introduites par les Européens (dont une épidémie de variole) qui ont littéralement décimé les habitants de l'île ne laissant en 1783 plus que 1500 Chamorros survivants[39]. Cet effondrement de la population a été compensé par l'apport de travailleurs philippins dont beaucoup se sont installés dans l'île, mélangeant leurs gènes à ceux de la population, en plus des mariages ou relations mixtes de Chamorros avec des Espagnols, soldats mexicains de l'armée espagnole d'occupation, et divers groupes de corsaires, baleiniers ou pirates aboutissant à une population dite néo-Chamorro avec un pool de gènes fortement renouvelés dès la fin du XIXe siècle[40]. Cette population est demeurée relativement stable génétiquement et a beaucoup augmenté au cours du XXe siècle. Avant le début du XXe siècle, les chroniqueurs n'ont cependant jamais fait état de maladie endémique évoquant le syndrome de Guam. - Une autre hypothèse a été qu'en raison d'un sol pauvre en calcium et magnésium, un hyperparathyroïdisme aurait favorisé le dépôt de calcium et d'aluminium dans les neurones jusqu'à ce que les importations de nourriture changent cette situation[5]. Mais alors, les générations précédentes auraient également dû être touchées...
Enjeux sanitaires et écologiques
Bien comprendre ce syndrome et son étiologie pourrait éclairer d'autres phénomènes d'augmentation de maladies neurodégénératives.
De plus, des pullulations anormales et nouvelles de cyanophycées, parfois massives, étant de plus en plus souvent observées en eau douce de surface en zone tempérée, dont dans des lacs ou réservoirs de barrages utilisés pour produire de l'eau potable, la confirmation de l'hyptothèse qu'il s'agit d'un « déclencheur environnemental bactérien » pour la SLA ou d'autres maladies neurodégénératives pourrait avoir d'énormes conséquences en termes de sécurité sanitaire[31].
Notes et références
- (en) Lytigo-bodig ; Elsevier
- Bradley WG, Mash DC., Beyond Guam: the cyanobacteria/BMAA hypothesis of the cause of ALS and other neurodegenerative diseases ; Amyotroph Lateral Scler. 2009; 10 Suppl 2:7-20. (résumé)
- "A Batty Hypothesis on the Origins of Neurodegenerative Disease Resurfaces, " Scientific American
- Karamyan VT, Speth RC., Animal models of BMAA neurotoxicity: a critical review ; Life Sci. 2008 Jan 30;82(5-6):233-46. Epub 2007 Dec 7. (résumé)
- Ralph M. Garruto, PhD; Richard yangihara, MD, & D. Carleton Gajdusek, MD, Disappearance of high-incidence amyotrophic lateral sclerosis and parkinsonism-dmentia on Guam, Neurology 1985, 35;193-198
- Koerner DR. Amyotrophic lateral sclerosis on Guam. A clinical study and review of the literature. Ann Intern Med 1952;37:1204–20 (Résumé)
- Arnold A, Edgren DC, Palladino VS. Amyotrophic lateral sclerosis. Fifty cases observed on Guam. J Nerv Ment Dis 1953;117:135–9.
- Plato, C.C.; Garruto, R.M.; Galasko, D.; Craig, U.; Plato, M.; Gamst, A.; Torres, J.M.; Wiederholt, W. (2003). "Amyotrophic lateral sclerosis and parkinsonism-dementia complex of Guam: Changing incidence rates during the past 60 years". American Journal of Epidemiology 157 (2): 149–157. doi:10.1093/aje/kwf175.
- Tillema S, Wijnberg CJ. Endemic amyotrophic lateral sclerosis on Guam; epidemiological data: a preliminary report. Doc Med Geogr Trop 1953;5:366–70.
- Kurland LT, Mulder DW. Epidemiologic investigations of amyotrophic lateral sclerosis. 1. Preliminary report on geographic distribution, with special reference to the Mariana Islands, including clinical and pathological observations. Neurology 1954;4:355–78, 438–48 (PDF, en anglais)
- Kurland LT, Mulder DW. http://www.neurology.org/content/5/4/249.full.pdf+html?ijkey=52c1ab36c7afa6d22fca22c8437aa1e0a88b06b4&keytype2=tf_ipsecsha Epidemiologic investigations of amyotrophic lateral sclerosis. 2. Familial aggregations indicative of dominant inheritance]. Neurology 1955;5:182–96, 249–68. (PDF, en anglais)
- Mulder DW, Kurland LT, Iriarte LLG. Neurologic diseases on the island of Guam. US Armed Forces Med J 1954;5:1724–39
- Hirano A, Kurland LT, Krooth RS, et al. Parkinsonism-dementia complex and endemic disease on the island of Guam. I. Clinical features. Brain 1961a;84:642–61.
- Hirano A, Kurland LT, Krooth RS, et al. Parkinsonism-dementia complex and endemic disease on the island of Guam. II. Pathologic features. Brain 1961b;84:662–70
- Plato CC, Cruz MT, Kurland LT. Amyotrophic lateral sclerosis/parkinsonism-dementia complex of Guam: further genetic investigations. Am J Hum Genet 1969;21:133–41.
- Bailey-Wilson JE, Plato CC, Elston RC, et al. Potential role of an additive genetic component in the cause of amyotrophic lateral sclerosis and parkinsonism-dementia in the western Pacific. Am J Med Genet 1993;45:68–76. (Résumé)
- Plato CC, Reed DM, Elisan TS, et al. Amyotrophic lateral sclerosis/parkinsonism-dementia complex of Guam. IV. Familial and genetic investigations. Am J Hum Genet 1967;19:617–32. (résumé)
- Reed DM, Plato CC, Elizan TS, et al. The amyotrophic lateral sclerosis/parkinsonism-dementia complex: a ten-year follow-up on Guam. Part I. Epidemiologic studies. Am J Epidemiol 1966;83:54–73. (Résumé et texte)
- Plato CC, Garruto RM, Fox KM, et al. http://aje.oxfordjournals.org/cgi/ijlink?linkType=ABST&journalCode=amjepid&resid=124/4/643 Amyotrophic lateral sclerosis and parkinsonism-dementia on Guam: a 25-year prospective case-control study]. Am J Epidemiol 1986;124:643–56.
- Plato CC, Galasko D, Garruto RM, et al. ALS and PDC of Guam. Forty-year follow-up. Neurology 2002;58:765–73 (Résumé)
- Garruto, R. M., Gajdusek, D. C. and Chen, K.-M. (1980), Amyotrophic lateral sclerosis among chamorro migrants from Guam. Annals of Neurology, 8: 612–619. doi: 10.1002/ana.410080612 (Résumé)
- Photos de l'arbre, des nodules, des fruits mangés par une roussette
- Cox PA, Banack SA, Murch SJ., Biomagnification of cyanobacterial neurotoxins and neurodegenerative disease among the Chamorro people of Guam. Proc Natl Acad Sci U S A. 2003 Nov 11; 100(23):13380-3. (Résumé)
- Lytico-bodig
- (en) Greg Miller, « Guam's Deadly Stalker: On the Loose Worldwide ? », Science, vol. 313, no 5786, , p. 428–431 (PMID 16873621, DOI 10.1126/science.313.5786.428)
- Banack SA, Cox PA., Biomagnification of cycad neurotoxins in flying foxes: implications for ALS-PDC in Guam, Neurology. 2003 Aug 12;61(3):387-9 (résumé)
- Kuzuhara, S., Kokubo, Y., Sasaki, R., Narita, Y., Yabana, T., Hasegawa, M. and Iwatsubo, T. (2001), Familial amyotrophic lateral sclerosis and parkinsonism-dementia complex of the Kii peninsula of Japan: Clinical and neuropathological study and tau analysis. Annals of Neurology, 49: 501–511. doi: 10.1002/ana.100 (Résumé)
- Ralph M. Garruto, Richard Yanagihara and D. Carleton Gajdusek, Models of environmentally induced neurological disease: epidemiology and etiology of amyotrophic lateral sclerosis and parkinsonism-dementia in the Western Pacific ; Environmental Geochemistry and Health Volume 12, Numbers 1-2, 137-151, DOI: 10.1007/BF01734063 (Résumé)
- R. M. Garruto, S. K. Shankar, R. Yanagihara, A. M. Salazar and H. L. Amyx, et al., Low-calcium, high-aluminum diet-induced motor neuron pathology in cynomolgus monkeys ; Acta Neuropathologica, 1989, Volume 78, Number 2, Pages 210-219
- Ince PG, Codd GA., Return of the cycad hypothesis - does the amyotrophic lateral sclerosis/parkinsonism dementia complex (ALS/PDC) of Guam have new implications for global health ? Neuropathol Appl Neurobiol. 2005 Aug; 31(4):345-53 ([Résumé])
- Banack SA, Caller TA, Stommel EW., The cyanobacteria derived toxin Beta-N-methylamino-L-alanine and amyotrophic lateral sclerosis ; Toxins (Basel). 2010 Dec;2(12):2837-50. Epub 2010 Dec 20 (Résumé)
- Salama M, Arias-Carrión O., Natural toxins implicated in the development of Parkinson's disease; Ther Adv Neurol Disord. 2011 Nov; 4(6):361-73.
- (en) Oliver Sacks, The Island of the Colorblind, New York, Random House, (ISBN 0679775455)
- Oxford Journal, étude anatomo-pathologique des maladies des neurones moteurs (en)
- Graphique présentant le nombre de cas annuellement déclaré (in Oxford Journal)
- Graphique des varitions d'incidence de la maladie (Oxford journal)
- Spoehr A. Marianas prehistory: archaeological survey and excavations on Saipan, Tinian, and Rota. In: Fieldiana: anthropology. Vol 48. Chicago, IL: Chicago Natural History Museum, 1957
- Carano P, Sanchez P. A complete history of Guam. Rutland, VT: Charles Tuttle Company, 1964
- Carano P, Sanchez P. A complete history of Guam. Rutland, VT: Charles Tuttle Company, 1964
- Spoehr A. Marianas prehistory : archaeological survey and excavations on Saipan, Tinian et Rota. In: Fieldiana: anthropology. Vol 48. Chicago, IL: Chicago Natural History Museum, 1957
Voir aussi
Articles connexes
- Guam
- Neuropathie
- Épidémiologie
- Éco-épidémiologie
- Neurotoxicité
- Écotoxicologie
- Toxicologie
- Nostoc
- Cyanobacteria
- Maladie neurodégénérative
- β-N-Méthylamino-L-alanine
- Santé-environnement
Liens externes
Bibliographie
- (en) Litvan Irene, Atypical Parkinsonian Disorders: Clinical And Research Aspects (Current Clinical Neurology); Humana Press ; Totowa ; (ISBN 1-58829-331-9) ; 47-48, 127-128
- (en) Wiederholt, W.C. 2000. Guam : the puzzle of Parkinson's. National Institute of Health Report 3:3.
- (en) Morris, H.R., Al-Sarraj, S., Schwab, C., Gwinn-Hardy, K., Perez-Tur, J., Wood, N.W., Hardy, J., Lees, A.J., McGreer, P.L., Daniel, S.E., and J.C. Steele. 2001. A clinical and pathological study of motor neurone disease on Guam. Brain 11:2215-2222.
- (en) Carrico, C. 2004. Island Lore. Beyond the bench : Representations of pharmacology and science in the media 4:296-297
- (en) Sedwick, L.A. 2003. Terry A. Cox, md, PhD, neuro-ophthalmologist, biostatistician, and birdwatcher. Journal of Neuro-Ophthalmology 23:108-110
- Portail de la médecine
- Portail des neurosciences