Stimulation cérébrale profonde
La stimulation cérébrale profonde est une méthode invasive consistant à implanter chirurgicalement dans le cerveau des électrodes, connectées à un boîtier mis en place sous la peau et qui délivre un courant électrique de faible intensité dans certaines structures spécifiques situées en profondeur de cet organe comme le thalamus, le noyau sous-thalamique ou le globus pallidus. Les sites stimulés peuvent varier selon l'indication. Ce traitement peut être utilisé pour traiter la maladie de Parkinson, les tremblements, les TOC et les dystonies.
Historique
La stimulation cérébrale profonde a été mise au point grâce à une collaboration du neurochirurgien Alim-Louis Benabid et du neurologue Pierre Pollak au CHU de Grenoble, dans les années 1980-1990.[réf. souhaitée]
Mode d'action
Il n'est pas bien connu. La stimulation électrique peut tout aussi bien activer qu'inhiber l'activité des neurones[1]. Elle favorise le relargage de glutamate et d'adénosine par les astrocytes[2], ce qui a pour conséquence d'abolir l'activité spontanément oscillante du thalamus[3].
Indications
Maladie de Parkinson
On peut proposer la mise en place de stimulation cérébrale profonde quand ces éléments sont réunis[4] :
- bonne réponse aux traitement par dopamine ;
- présence de fluctuations on-off ;
- dyskinésie sévère diminuant la qualité de vie ;
- tremblement résistant aux médicaments ;
- et fonctions cognitives relativement conservées.
La stimulation cérébrale profonde améliore aussi bien les symptômes que la qualité de vie des patients résistants au traitement habituel[4]. L'efficacité semble être prolongée, avec un recul de plus de 10 ans pour certains patients[5]. En cas d'échec, un repositionnement de l'électrode, voire son changement ou une modification de sa cible anatomique peuvent être proposés[6].
La cible peut être le noyau sous-thalamique ou le globus pallidus, les deux sites étant équivalents en termes d'efficacité[7]. Elle peut être unilatérale ou bilatérale en cas de résultats insuffisants[8].
Autres
Les autres indications sont essentiellement en cours d'évaluation.
Quelques essais ont été faits lors de dépressions graves et résistantes[9] avec des résultats favorables[10]. Elle permettrait d'améliorer les troubles obsessionnels compulsifs[11].
Elle est en cours de test dans l'anorexie mentale[12] ou dans la maladie d'Alzheimer[13] ainsi que la maladie de Gilles de la Tourette[14].
Réalisation
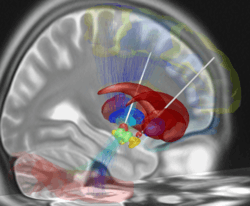
Une imagerie cérébrale par scanner ou par IRM est faite afin de visualiser la cible de la stimulation. Des repères sont mis en place sur la peau du crâne pour le repérage tridimensionnel. Le trajet de l'implantation est alors fixé, en tenant compte de la position des vaisseaux sanguins afin de les éviter.
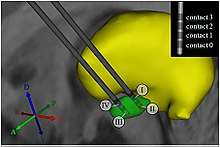
La procédure est faite idéalement chez un patient éveillé et ayant arrêté ses traitements neurologiques afin d'évaluer précisément le retentissement de la mise en place des électrodes. Ces dernières sont introduites, après anesthésie locale, à travers une petite ouverture effectuée dans le crâne et sont positionnées dans la cible soit à l'aide d'une reconstruction tridimensionnelle du cerveau du patient, soit sous contrôle direct d'une IRM[4]. Les électrodes sont alors fixées au crâne et sont tunnelisées sous la peau jusqu'au lieu d'implantation du boîtier (zone sous-claviculaire). Ce dernier est mis en place sous la peau et connecté aux électrodes.
L'implantation d'électrodes pour des procédures fonctionnelles (stimulation cérébrale profonde, stimulation du cortex cérébral) est un exemple où l'aide d'un robot peut être appréciable.
Incidents et accidents
Comme pour toute implantation de matériel, les deux principales complications sont l'infection et l'hémorragie.
Le taux d'infection peut atteindre 5 %, restant en règle générale extra cérébrale mais imposant le retrait du matériel[15]. Le risque hémorragique est comparable, souvent sans conséquence, mais peut conduire plus rarement, à un déficit neurologique irréversible ou au décès[16].
Des troubles de l'humeur peuvent survenir[17]. Une conduite addictive pourrait être également favorisée[18]. Il n'a pas été décrit de troubles cognitifs mais une baisse de la fluence verbale[19] (le patient parle plus lentement).
Surveillance
Le système est mis en route quelques semaines après l'implantation afin d'attendre la réabsorption d'un éventuel œdème cérébral local[4].
Le réglage joue sur la fréquence de stimulation (130 à 185 Hz) la largeur des impulsions (60 à 120 μs) et l'amplitude de ces dernières (2,0 à 5,0 V) et doit être adapté pour chaque patient[4].
La présence d'une stimulation profonde cérébrale rend très souvent l'électrocardiogramme du patient ininterprétable du fait des artéfacts électriques et impose l'inhibition transitoire du stimulateur pour pouvoir obtenir un tracé correct.
Coût
La technique reste coûteuse du fait du matériel, de l'implantation et de la surveillance. Par exemple, son coût a été estimé en Allemagne à plus de 20 000 euros la première année (2005). Il est divisé par trois les années suivantes (simple surveillance)[20].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Deep brain stimulation » (voir la liste des auteurs).
- (en) Vitek JL, « Mechanisms of deep brain stimulation: excitation or inhibition » Mov Disord. 2002;17:Suppl 3:S69-S72.
- (en) Tawfik VL, Chang SY, Hitti FL et al. « Deep brain stimulation results in local glutamate and adenosine release: investigation into the role of astrocytes » Neurosurgery 2010;67:367-375.
- (en) Lee KH, Hitti FL, Chang SY et al. « High frequency stimulation abolishes thalamic network oscillations: an electrophysiological and computational analysis » J Neural Eng. 2011;8:046001-046001.
- (en) Okun MS, « Deep-brain stimulation for Parkinson's disease » N Engl J Med. 2012;367:1529-1538.
- (en) Castrioto A, Lozano AM, Poon YY, Lang AE, Fallis M, Moro E, « Ten-year outcome of subthalamic stimulation in Parkinson disease: a blinded evaluation » Arch Neurol. 2011;68:1550-1556.
- (en) Ellis TM, Foote KD, Fernandez HH et al. « Reoperation for suboptimal outcomes after deep brain stimulation surgery » Neurosurgery 2008;63:754-760.
- (en) Follett KA, Weaver FM, Stern M et al. « Pallidal versus subthalamic deep-brain stimulation for Parkinson's disease » N Engl J Med. 2010;362:2077-2091.
- (en) Taba HA, Wu SS, Foote KD et al. « A closer look at unilateral versus bilateral deep brain stimulation: results of the National Institutes of Health COMPARE cohort » J Neurosurg. 2010;113:1224-1229.
- (en) Kennedy SH, Giacobbe P, Rizvi SJ et al. Deep brain stimulation for treatment-resistant depression: follow-up after 3 to 6 years, Am J Psychiatry, 2011;168:502-510.
- (en) Mayberg HS, Lozano AM, Voon V et al. « Deep brain stimulation for treatment-resistant depression » Neuron. 2005;45:651-660.
- (en) Greenberg BD, Malone DA, Friehs GM et al. « Three-year outcomes in deep brain stimulation for highly resistant obsessive-compulsive disorder » Neuropsychopharmacology. 2006;31:2384-2393.
- (en) Lipsman N, Woodside DB, Giacobbe P et al. « Subcallosal cingulate deep brain stimulation for treatment-refractory anorexia nervosa: a phase 1 pilot trial » Lancet. 2013;381:1361-1370.
- (en) Laxton AW, Tang-Wai DF, McAndrews MP et al. « A phase I trial of deep brain stimulation of memory circuits in Alzheimer's disease » Annals of Neurology (en). 2010;68:521-534.
- (en) Vandewalle V, van der Linden C, Groenewegen HJ, Caemaert J, « Stereotactic treatment of Gilles de la Tourette syndrome by high frequency stimulation of thalamus » Lancet. 1999;353:724.
- (en) Sillay KA, Larson PS, Starr PA, « Deep brain stimulator hardware-related infections: incidence and management in a large series » Neurosurgery 2008;62:360-366.
- (en) Zrinzo L, Foltynie T, Limousin P, Hariz MI. « Reducing hemorrhagic complications in functional neurosurgery: a large case series and systematic literature review » J Neurosurg. 2012;116:84-94
- (en) Temel Y, « Limbic effects of high-frequency stimulation of the subthalamic nucleus » Vitam Horm. 2010;82:47-63.
- (en) Moum SJ, Price CC, Limotai N et al. « Effects of STN and GPi deep brain stimulation on impulse control disorders and dopamine dysregulation syndrome » PLoS One 2012;7:e29768-e29768.
- (en) Parsons TD, Rogers SA, Braaten AJ, Woods SP, Troster AI, « Cognitive sequelae of subthalamic nucleus deep brain stimulation in Parkinson's disease: a meta-analysis » Lancet Neurol. 2006;5:578-588.
- (en) [PDF] Meissner W, Schreiter D, Volkmann J et al. « Deep brain stimulation in late stage Parkinson's disease: a retrospective cost analysis in Germany » J Neurol. 2005;252:218-223.