Herpès génital
L'herpès génital est une maladie infectieuse sexuellement transmissible ou indirectement par les doigts ayant été en contact avec une autre partie du corps infectée (bouton de fièvre) causée par le virus Herpes simplex (HSV) de type 1 ou 2.

| Type | Virus |
|---|---|
| Groupe | |
| Famille | Herpesviridae |
| Sous-famille | Alphaherpesvirinae |
| Genre | Simplexvirus |
Espèce
Herpes Simplex 2 (HSV-2)
— auteur incomplet —, date à préciser
Elle consiste en des démangeaisons, brûlures, petites cloques, plaies au niveau des organes génitaux.
Le traitement consiste en des antiviraux pour diminuer la contagiosité, réduire la douleur, la durée et la fréquence des crises.
C'est une infection considérée sans gravité mais qui empêche les rapports sexuels pendant les poussées.
Il s'agit d'un cofacteur important de transmission du virus de l'immunodéficience humaine responsable du SIDA.
Épidémiologie
Les infections génitales peuvent être causées par le virus Herpes simplex (HSV) de type 1 ou 2 mais le HSV-2 est le plus courant (environ 70 % des cas). Les infections récurrentes à HSV-2 sont très fréquentes (98 % des patients). Le HSV-1 est moins virulent et peut provoquer des symptômes plus mineurs, tels que les boutons de fièvre (herpès labial).
Les personnes atteintes sont pour la plupart asymptomatiques.
L'incidence aux États-Unis est estimée entre 1 et 2 millions de nouveaux cas annuels. La prévalence chez les 30-40 ans atteint près de 30 %[1].
Mécanisme de la contamination
L’infection se transmet par :
- un contact entre une muqueuse infectée et une muqueuse saine (coït) ;
- un contact entre peau infectée et peau saine (une personne a un herpès sur un testicule et le transmet sur les fesses du partenaire) ;
- un contact entre peau ou muqueuse et sécrétion vaginale infectée ;
- un contact entre peau ou muqueuse et salive infectée.
Il semble que pour qu'il y ait infection sur la peau par les fluides (salive ou sécrétion vaginale), il est nécessaire que la peau soit abîmée.
Quand il entre dans la zone génitale, le virus peut ressortir à n'importe quel endroit dans la zone génitale (par exemple, il entre par un contact gland/fesse mais peut ressortir sur le vagin lors d'une poussée).
Les cas d’auto-inoculation à partir d’un site d’infection oral ou labial antérieure à HSV-1 sont rares et arrivent le plus souvent durant la primo-infection orale (une personne a un herpès sur la bouche pour la première fois, touche les vésicules puis se touche le sexe).
L’excrétion et la transmission asymptomatique (la personne qui est contagieuse n'a aucun signe lui faisant penser qu'elle a une poussée d'herpès) du virus sont fréquentes surtout pour le HSV-2.
Histoire naturelle
- La première infection (primo-infection) est souvent silencieuse.
- La période habituelle d’incubation (délai entre l'infection et les premiers signes) des primo-infections symptomatiques varie entre 2 et 21 jours.
- Les infections récidivantes se retrouvent habituellement sur le territoire des dermatomes S2 ou S3 (territoire de la peau innervé par la deuxième ou troisième racine sacrée).
- Les récidives sont fréquemment atypiques quant à leur présentation.
Signes cliniques

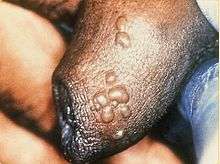
Primo-infection
Il s’agit du premier épisode avec signes chez un patient n'ayant jamais été au contact du HSV jusque-là.
On observe une éruption vésiculeuse et ulcérative aux points d’inoculation du virus ou à proximité. L’infection est localisée au niveau des organes génitaux externes, du pubis, du périnée et des régions péri-anales, ainsi qu’au niveau du col de l’utérus, de l’anus ou de l’urètre, suivant le type de contact. Une adénopathie (gros ganglion) au pli de l'aine, douloureuse, est fréquente. L'éruption guérit sans traitement, en règle générale, en une dizaine de jours[2].
- Les problèmes urinaires, y compris les retards à l’initiation de la miction ou une difficulté à uriner (dysurie), sont fréquents chez les hommes et les femmes et ils peuvent durer longtemps.
- De 40 à 70 % des primo-infections s’accompagnent de symptômes généraux, par exemple fièvre ou douleurs musculaires.
- Une méningite bénigne est observée dans 10 à 30 % des cas de primo-infection symptomatique. La ponction lombaire ramène dans ce cas un liquide stérile.
Infection non primaire
- Il s’agit du premier épisode avec signes cliniques chez un patient ayant déjà eu un contact avec le HSV, qu'il soit symptomatique ou non.
- La durée est habituellement moins longue et il est rare que les symptômes intéressent l’organisme entier.
- On peut observer une éruption vésiculeuse et ulcérative unilatérale ou bilatérale (chez les femmes) s’apparentant plutôt à une infection récurrente symptomatique.
Infection récurrente
- La première éruption ne se manifeste jamais tout de suite après la contamination. Il faut d'abord que le virus s'installe avant de produire des éruptions, ce qui peut prendre plusieurs semaines. La période de latence peut parfois être de plusieurs années, certains patients ne présentant aucun symptôme jusqu'à 20 ans après la primo-infection.
Infection récurrente symptomatique
- Elle est due à une réactivation du virus latent.
- Les symptômes sont moins graves et durent moins longtemps que dans le cas d’une primo-infection symptomatique.
- Les manifestations de l’infection se limitent généralement aux organes génitaux externes et sont unilatérales.
Excrétion asymptomatique
Elle est observée chez des personnes ayant ou non des épisodes symptomatiques. Elle s’effectue à plusieurs endroits au niveau des organes génitaux et elle est plus fréquente dans le cas du HSV-2.
Examen de laboratoire
Pour établir le diagnostic clinique, il faut retrouver les éléments suivants : des lésions typiques ou atypiques et une culture.
La culture, après prélèvement au niveau de la lésion, demeure la méthode de prédilection à cause de sa spécificité, de sa sensibilité et de sa capacité de typer la souche du virus. Le typage de la souche est souhaitable dans la plupart des cas pour permettre de mieux prévoir les récurrences ainsi que de fournir des renseignements pertinents sur la susceptibilité du partenaire. La réaction en chaîne par polymérase (PCR) permet également d'en établir le diagnostic.
En revanche, la sérologie a une application clinique limitée. Elle consiste en la détection d'anticorps dirigés contre le HSV dans le sang du patient. La détection de ces derniers signe un contact antérieur avec le virus mais de manière retardée. Elles peuvent être utilisées pour déterminer si les femmes enceintes qui n’ont pas d’antécédents d’herpès symptomatique sont à risque. Elle ne peut déterminer naturellement s'il s'agit d'une primo infection ou d'une récidive mais peut définir le type de virus en cause (HSV 1 ou 2).
Traitement
Les traitements sont de deux types : oral (traitement préventif) ou local (pommade à appliquer, traitement curatif des poussées d'herpès). Il faut traiter systématiquement et le plus tôt possible, c'est-à-dire dès l'apparition des signes annonciateurs d'une poussée d'herpès (démangeaisons, gênes ou irritations), ce qui aiderait à réduire la fréquence des crises et les douleurs afférentes.
L'utilisation de préservatifs ne protège pas complètement du risque de transmission de la maladie, ce dernier n'étant réduit que d'environ 30 %[3].
Dans tous les cas, des antalgiques peuvent être utiles et des soins d'hygiènes restent utiles pour éviter une infection bactérienne surajoutée.
Primo-infection
Le traitement antiviral est utile pour atténuer les symptômes, les complications et l’excrétion du virus, mais il est efficace seulement s’il est administré au début de l’épisode symptomatique. Il ne permet pas de prévenir les récidives, sauf s'il est donné de manière prolongée[2].
- Aciclovir 400 mg trois fois par jour pendant 5 à 7 jours
- Famciclovir 250 mg trois fois par jour pendant 5 à 7 jours
- Valaciclovir 500 à 1 000 mg deux fois par jour pendant 5 à 7 jours
Infections récurrentes
- Famciclovir 125 mg per os deux fois par jour pendant 5 jours
- Valaciclovir 500 mg per os deux fois par jour pendant 5 jours
- Acyclovir 400 mg per os trois fois par jour pendant 5 jours
Cas de la femme enceinte
Le nouveau-né peut être contaminé par la mère lors de l'accouchement s'il existe des lésions actives secondaire au HSV au niveau de la sphère génitale maternelle, provoquant un Herpès néo-natal aux conséquences dramatiques.
Si la primo-infection survient lors du troisième trimestre, un accouchement à terme par césarienne est impératif, prévenant ainsi la contamination[2]. La même attitude est prônée en cas de présence de lésions d'herpès au niveau de la sphère génitale secondaire à une récidive.
Autres traitements
De nombreux traitements non médicamenteux ont été proposés, à base de plantes, de compléments alimentaires ou d'huiles dites essentielles. Aucun n'a démontré de manière scientifique une quelconque efficacité.
S'agissant d'une infection sexuellement transmissible, les rapports protégés voire une abstinence (si les lésions ne sont pas couvertes par le préservatif) sont conseillés lors de la phase éruptive.
Dans un couple séro-discordant (une personne infectée, l'autre saine) il convient d'utiliser un préservatif pour tous les rapports car il est impossible de prévoir quand la personne infectée est contagieuse (on estime à au moins 5 à 10 % des jours de l'année le nombre de jours où une personne positive est contaminante sans symptôme). Cela n'exclut pas la contamination par d'autres voies (peau-peau)
Pour un couple séro-discordant ayant des rapports non protégés, on estime à 10 % de risque d'infecter le partenaire chaque année.
Vaccins
Il n'existe pas, à ce jour, de vaccination disponible. Différentes approches ont été étudiées par les chercheurs, et elles représentent un véritable défi pour la recherche[4]. De nombreuses pistes ont déjà été tentées[5],[6]. La récente découverte que les cellules T permettent de différencier les individus symptomatiques et asymptomatiques pourrait conduire à un progrès fondamental dans le développement immunologique d'un vaccin contre l'herpès[7].
Échecs
Au cours des deux dernières décennies, de nombreux efforts ont été faits pour tenter de développer un vaccin contre l'herpès oculaire et génital. Malgré des résultats prometteurs sur les études animales, les essais cliniques ont été décevants.
Fin septembre 2010, GlaxoSmithKline a décidé de ne pas poursuivre le développement de son vaccin Herpevac/Simplirir, à la suite des résultats obtenus en phase III aux États-Unis[8]. Les essais avaient débuté en 2003. Entre 1996 et 1999, le même laboratoire avait déjà testé un vaccin en phase III, le gD2t avec l'adjuvant GSK208141, sans suite.
Le laboratoire AuRx n'a jamais réussi à trouver les financements pour poursuivre le développement de son projet de traitement immunitaire[9].
Cytogenix travaillait sur le CY301 (Simplivir) (phase pré-clinique) une crème visant à annuler la capacité de reproduction du virus et son aptitude à migrer vers les cellules nerveuses, mais a gelé ses études par manque de moyens[10].
D'autres sociétés ont suspendu ou abandonné leurs recherches, et notamment Chiron Corp (Novartis), Genvec[11], Tekron et Biovirus[12], Replicor[13] PowderMed et le pPJV7630 (Pfizer), ou bien encore Astellas Pharma Inc. et son antiviral ASP2151.
Il est probable qu'un certain nombre de petites sociétés de biotechnologie aient cherché à attirer des investisseurs sous de fausses promesses. Un certain nombre de recherches passées n'ont pas vu le jour, soit par manque de financement pour aller jusqu'au bout des essais, soit à la suite du rachat par un grand laboratoire, laissant planer un doute sur l’intérêt économique pour les grands laboratoires d'un tel vaccin. Les ventes de vaccins étant non récurrentes par rapport à celles des médicaments antiviraux actuellement sur le marché.[réf. nécessaire]
Espoirs
Restent à ce jour d'autres pistes de vaccins en étude et notamment :
- Antigenics et le AG707 (phase I)[14] qui travaille avec David Koelle de l'université de Washington[15] sur un vaccin. L'étude en phase I a débuté en mars 2008 aux États-Unis sur 35 personnes[16] et les résultats ont été dévoilés en juillet 2010[17]. Le AG-707 administré avec l'adjuvant QS21 ont entrainé une induction significative des réponses immunitaires des cellules CD4 + et CD8 +. La société cherche à présent un partenaire pour poursuivre le développement du projet.
- BioVex et son ImmunoVEX (phase I)[18] a débuté en février 2010 une étude en phase I sur un vaccin sur 42 personnes en Angleterre. ImmunoVEX HSV2 est un vaccin vivant atténué qui a été conçu pour supprimer les gènes qui permettent aux virus de l'herpès d'éviter le système immunitaire. Le système immunitaire peut ainsi reconnaître le virus et se défendre.
- Beechtreelabs et BTL-TML-HSV (phase I)[19] une molécule qui inhibe le ré-assemblage des particules virales après l'infection des cellules. Les essais cliniques ont débuté en septembre 2010 sur 210 patients aux États-Unis.
- Vicale et son Vaxfectin (phase pré-clinique) a présenté les résultats de la phase préclinique fin octobre 2010[20]. Il s'agit d'un vaccin prophylactique avec un adjuvant.
- Vironova et le Herpes VN-180 (phase pré-clinique) qui permettrait de bloquer le processus de réplication du virus[21].
- Sanofi Pasteur et son ACAM-529 (phase pré-clinique). Début 2005, David Knipe de la Harvard Medical School[22] a développé un vaccin sous le nom de dl5-29. Ses études ont été poursuivies par le laboratoire Acambis, racheté en juillet 2008 par Sanofi. La molécule est présent suivie par Harry Kleanthous et Simon Delagrave de Sanofi Pasteur sous le nom ACAM-529. Ce vaccin repose sur la suppression des gènes UL29 et UL5 sur le HSV-2.
Les recherches sur les antiviraux sont plus avancées :
- AiCuris et le AIC316 (phase II)[23] qui prépare un nouveau médicament antiviral qui se veut plus performant que les médicaments actuels[24] ;
- Nanobio et son anti-infectieux NB-00X et sa crème NB-001 (phase II)[25]. En décembre 2009, NanoBio Corporation a signé un accord avec GlaxoSmithKline pour l'utilisation du brevet de la crème NB-001 pour l'herpès labial ;
- Nonoviricides et son anti-herpes[26] étudié par le professeur Ken S. Rosenthal's de la Northeastern Ohio Universities depuis mai 2010. Le produit prendrait la forme d'une crème qui bloquerait le développement du virus sur les cellules non infectées.
Dans les recherches on trouve également un certain nombre de travaux universitaires en cours :
- l'équipe du professeur William Halford de l'université d'Illinois[27] a mis en ligne un brevet de vaccin reposant sur une version mutante du HSV[28],[29]. Cette technique a été critiquée et jugée comme étant dangereuse, car elle utilise l'ensemble du virus vivant plutôt qu'un fragment de protéine. Cela va à l'encontre de la plupart des recherches depuis les années 1970, mais Halford fait valoir que cette technique a fait ses preuves pour les vieux vaccins pour enfants contre la rougeole, les oreillons et la rubéole ;
- l'équipe du professeur Bryan R. Cullen du Département de Génétique Moléculaire de l'Université de Duke travaille sur un médicament qui permettrait d'activer complètement le HSV1 en inhibant les microARN artificiellement. Le HSV1 pourrait alors ensuite être éliminé complètement par les antiviraux actuels[30] ;
- l'équipe des professeurs David Bloom et Alfred Lewin de l'Université de Floride travaille sur un ribozyme qui bloquerait le HSV-1[31] ;
- l'équipe du professeur Robert L. Hendricks de l'université de Pittsburg[32] qui travaille sur les réponses immunitaires au HSV-1 ;
- l'équipe du professeur Howard M. Johnson de l'Université de Floride qui a développé une peptide pour les thérapies antivirales[33] ;
- l'équipe du professeur Staffan Görander de l'université Sahlgrenska à Gothenburg en Suède qui a publié des travaux[34] sur les fonctions de l'enveloppe en glycoprotéine G du HSV-2 ;
- l'équipe du professeur Lbachir BenMohamed et d'Anthony Nesburn de l'Université de Californie a développé un vaccin pour le traitement de l'herpès génital et oculaire. Le développement de ce vaccin est poursuivi par leur société Micro Antigen Technologies[35].
Enfin, le Lupidon est un vaccin développé en 1971 à partir de HSV inactivé. Ce vaccin est toujours commercialisé en Allemagne, Suisse, Autriche et Italie. Son efficacité est discutée compte tenu qu'il doit être renouvelé tous les 9 mois. Il est utilisé dans ces pays uniquement dans les cas les plus graves[36].
Herpès génital et VIH
En raison des ulcérations génitales provoquées par l'herpès, le risque de contamination par le VIH est doublé[37].
De même l'herpès génital peut favoriser l'installation d'une candidose (mycose due au champignon Candida). Les signes cliniques des deux pathologies étant proches, la confusion est courante.
Notes et références
- Chiffres de l'OMS
- (en) Sen P, Barton SE, « Genital herpes and its management » BMJ 2007:334:1048-1052.
- (en) Martin ET, Krantz E, Gottlieb SL. et al. « A pooled analysis of the effect of condoms in preventing HSV-2 acquisition » Arch Intern Med. 2009;169:1233-1240.
- (en) Development of genital herpes vaccines: prospects and challenges
- Liste des projets de vaccins
- Liste de projets de vaccins
- (en) New concepts in herpes simplex virus vaccine development: notes from the battlefield
- (en) GSK has made the decision not to pursue further worldwide development of Simplirix sur www.gsk.com
- AuRx et son traitement immunitaire en phase II sur www.aurx.com
- (en) Cytogenix Simplivir Cream sur www.cytogenix.com
- Genvec
- (en) Tekron, Inc. Announces Application for a $30 million grant to Advance Herpetic Vaccines Against Herpes Simplex
- Replicor
- (en) A heat shock protein based vaccine
- (en) Researcher David Koelle: Toward a vaccine for herpes
- (en) Clinicaltrials sur le AG707
- (en) Antigenics Presents Positive, Top Line Data from Phase I Herpes Clinical Trial
- (en) ImmunoVEX HSV2, a vaccine for genital herpes sur www.biovex.com
- (en) Herpes Beechtreelabs
- (en) Vical et son Vaxfectin
- (en) Viranova Herpes VN-180
- (en) David Knipe Findings Recommend Herpes Vaccine for Human Trials sur www.webweekly.hms.harvard.edu
- (en) AiCuris Presents Preclinical and Phase 1 Data of its anti-HSV drug AIC316 sur www.aicuris.com
- (en) Clinical Trials Phase II
- (en) Genital Herpes sur www.nanobio.com
- (en) Nanoviricides anti-herpes
- (en) Southern Illinois University School of Medicine Medical Microbiology, Immunology and Cell Biology sur www.siumed.edu
- Brevet du HSV Virus Mutant ICP0
- (en) Halford WP, Püschel R, Rakowski B. « Herpes simplex virus 2 ICP0- mutant viruses are avirulent and immunogenic: implications for a genital herpes vaccine » PLoS One. 2010;5(8):e12251. DOI:10.1371/journal.pone.0012251
- (en) Bryan Cullen Lab Duke University
- Université de Floride
- (en) Dr. Hendricks’ research focuses on three important aspects of the immune response to herpes simplex virus type 1 sur www.gradbiomed.pitt.edu
- (en) Novel Peptide for Broad Antiviral Therapy Including Influenza Viruses sur apps.reseach.ufl.edu
- (en) Functions of glycoprotein G of herpes simplex virus type 2 sur gupea.ub.gu.se
- (en) Université de Californie
- Bruschettini commercialise le Lupidon Lupidon
- (en) Wald A, Link K. « Risk of human immunodeficiency virus infection in herpes simplex virus type 2 seropositive persons: a meta-analysis » J Infect Dis. 2002;185:45-52.
Voir aussi
Articles connexes
Lien externe
- Herpessante site d'information de l'Agence de santé publique du Canada qui donne des conseils pour vivre avec le virus de l'herpès.
- Portail de la médecine
- Portail de la virologie