Déficit en acyl-coenzyme A déshydrogénase des acides gras à chaîne moyenne
Le déficit en acyl-CoA déshydrogénase des acides gras à chaîne moyenne (en anglais Medium-chain acyl-coenzyme A dehydrogenase deficiency), souvent connu sous le nom de déficience en MCAD ou MCADD est un trouble de l'oxydation des acides gras qui compromet la capacité du corps à décomposer les chaînes des acides gras moyennes Acyl-CoA vers l'Acétyl-CoA. Le trouble est caractérisé par l'hypoglycémie et la mort subite sans une intervention rapide, le plus souvent provoquée par des périodes de jeûne ou de vomissements.
| Spécialité | Endocrinologie |
|---|
| CIM-10 | E71.3 |
|---|---|
| CIM-9 | 277.85 |
| OMIM | 201450 |
| DiseasesDB | 7914 |
| eMedicine | 946755 |
| eMedicine | ped/1392 |
| MeSH | C536038 |
![]()
Avant l'élargissement des dépistages des nouveau-nés via le test néonatal du buvard, la MCADD était une cause de mort subite chez les nourrissons la plus souvent sous-diagnostiquée. Les personnes qui ont été identifiées avant l'apparition des symptômes ont un excellent pronostic.
La MCADD est plus répandue chez les personnes d'Europe du Nord d'origine caucasienne, avec une incidence de 1:4000 à 1:17 000 personnes selon la population. Le traitement de la MCADD est essentiellement préventif, en évitant le jeûne et d'autres situations où le corps repose sur l'oxydation des acides gras pour l'approvisionnement en énergie.
Signes et symptômes
La MCADD se présente dans la petite enfance avec des hypoglycémie hypocétonémique et un dysfonctionnement du foie, souvent dû à de longues périodes de jeûne ou une infection avec des vomissements. Les nourrissons qui sont exclusivement nourris au sein peuvent présenter, peu de temps après la naissance, les symptômes en cas de mauvaise alimentation. Chez certaines personnes, la première manifestation de la MCADD peut-être la mort subite à la suite d'une maladie mineure. Un certain nombre d'autres personnes avec la MCADD peuvent être complètement asymptomatiques, à condition de ne jamais rencontrer une situation suffisamment stressante pour leur métabolisme. Avec l'avènement de l'élargissement du dépistage des nouveau-nés, certaines mères ont été identifiées avec le MCADD après que leurs enfants eut été détecté avec des résultats positifs au test néonatal du buvard sur le niveau de carnitine.
L'enzyme MCAD est responsable de l'étape de déshydrogénation d'acides gras avec des longueurs de chaîne entre 6 et 12 atomes de carbone lors de la bêta-oxydation dans les mitochondries. La bêta-oxydation des acides gras fournit de l'énergie à l'organisme après que le corps ait utilisé ses réserves de glucose et de glycogène. Cette oxydation se produit généralement pendant les périodes de jeûne où de maladie lorsque l'apport calorique est réduit, et les besoins énergétiques sont augmentés.
Génétique
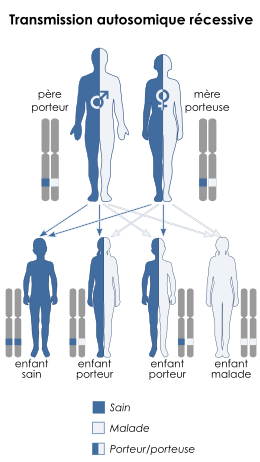
La MCADD est transmise selon un mode Autosomique récessive, ce qui signifie qu'une personne touchée doit hériter d'un allèle muté (un des deux exemplaires d'un gène) de ses deux parents. Le gène ACADM[1] est le gène impliqué, situé sur le gène 1, position 31, avec 12 exons et codant une protéine de 421 acides aminés. Il y a une mutation commune en Europe du Nord, la mutation 985A>G, où une lysine est remplacé par un acide glutamique en position 304 de la protéine. De nombreuses autres mutations ont été identifiées depuis le dépistage néonatal, qui a élargi le spectre de la mutation. La mutation 985A>G est présente dans les gênes homozygotes de 80 % des personnes de race blanche qui ont présenté des signes cliniques de MCADD et 60 % de la population identifiés en phase de dépistage.
Un génotype d'un individu n'est pas en corrélation directe avec le phénotype pour la MCADD. L'état clinique d'une personne avec la MCADD ne dépend donc pas seulement de la présence de mutations dans le gène ACADM, mais aussi de la présence de stress environnementaux ou physiologiques qui obligent le corps à dépendre de l'oxydation des acides gras pour produire de l'énergie. Certaines mutations, identifiés par les programmes de dépistage néonatal et associées avec une plus grande activité enzymatique résiduelle n'ont pas été observées chez les individus présentant des symptômes cliniques de MCADD. Malgré cela, le traitement par l'évitement du jeûne reste la norme pour tous ces individus.
Diagnostic
Cliniquement, la MCADD ou un autre trouble de l'oxydation des acides gras est suspectée chez les personnes qui se présentent avec un état léthargique, des convulsions, un coma ou une hypoglycémie hypocétonémique, en particulier si l'état est déclenché par une maladie mineure. Si la MCADD est présente avec une maladie hépatique aiguë et une hépatomégalie, cela peut conduire à une erreur de diagnostic du syndrome de Reye.
Chez certaines personnes, la seule et unique manifestation de la MCADD est la mort soudaine et inexpliquée, étant souvent précédée par une maladie mineure qui n'est généralement pas mortelle.

Dans les zones où le dépistage des nouveau-nés à l'aide de la spectrométrie de masse en tandem (MS/MS) est effectué, la MCADD est généralement détectée peu de temps après la naissance, par l'analyse des taches de sang prélevé sur papier buvard. Le profilage de l'acylcarnitine avec la spectrométrie MS/MS montrera un motif caractéristique de l'élévation de la hexanoylcarnitine (C6), octanoylcarnitine (C8), decanoylcarnitine (C10) ou decenoylcarnitine (C10:1), avec le C8 supérieure à C6 ou C10.
Une carence en carnitine secondaire est parfois vue avec la MCADD, et dans ces cas, le profilage d'Acylcarnitine peut ne pas être informatif. Les analyses d'urine organique par chromatographie en phase gazeuse-spectrométrie de masse (GC-MS) montrent une présence d'acidurie dicarboxylique avec de faibles niveaux de cétones. Des traces d'acylglycine peuvent également être détectés. Chez les personnes asymptomatiques, les résultats biochimiques à la suite d'une analyse laboratoire peuvent ne rien révéler. Pour ces personnes, une analyse ciblée d'acylglycine par chromatographie en phase gazeuse-spectrométrie de masse (GC-MS), spécifiquement l'hexanoylglycine et la suberylglycine peut aider au diagnostic.
À la suite de soupçons de MCADD par biochimie, la génétique moléculaire permettra l'analyse du gène ACADM pour confirmer le diagnostic. L'analyse de l'activité du MCAD dans des cultures de fibroblastes peut également être utilisé pour le diagnostic.
Dans les cas de mort subite ou dans les cas de mort à la suite d'une maladie généralement non fatale, la MCADD est souvent suspectée. L'autopsie montrera alors souvent des dépôts de gras dans le foie. Dans les cas où la MCADD est suspectée, l'analyse d'acylcarnitine dans la bile et dans le sang peut être entreprise pour le diagnostic post-mortem. Lorsque les échantillons ne sont pas disponibles, les résidus de sang du dépistage des nouveau-nés peuvent être utiles. Des tests biochimiques sur les frères, sœurs et parents peuvent aussi être utile, même si ceux-ci sont asymptomatique. La MCADD et les autres désordres de la Bêta-oxydation des acides ont été reconnus ces dernières années en tant que cause non diagnostiquée de la mort subite du nourrisson.
Dépistage
En France
En France, la haute autorité de santé recommande le dépistage de la MCADD depuis 2011. Le ministère de la santé tarde cependant à équiper les laboratoires chargés des dépistages néonataux pour traiter celui de la MCADD et de plusieurs autres maladies[2],[3].
Au Québec
Depuis 2011, les enfants nés au Québec sont dépistés pour la MCADD dès la naissance[4].
Aux États-Unis
À la suite de la recommandation de l'American College of Medical Genetics, les 50 états offrent le dépistage de la MCADD depuis 2006[5].
Traitement
Comme avec la plupart des autres troubles de l'oxydation des acides gras, les personnes avec la MCADD ont l'obligation d'éviter le jeûne pendant de longues périodes de temps[6]. Lorsque ceux-ci sont malades, une gestion rigoureuse doit être faite afin d'éviter les décompensations métaboliques qui peuvent entrainer la mort. La supplémentation en glucides simples ou en glucose au cours de la maladie est la clé pour éviter le catabolisme.
Nutrition[7]
De 0 à 6 mois
Chez le nourrisson, durant les six mois suivant la naissance, une période maximale de 3 à 4 heures de jeûne doit être respectée. L'allaitement maternel reste, comme pour les nourrissons non atteints de la MCADD, recommandé. Les substituts de lait maternel enrichis en gras sont cependant à proscrire.
De 7 mois à 1 an
Durant cette période, les périodes de jeûne sont peu à peu augmentées en suivant le principe d'environ une heure par mois :
- 5-6 heures à 7 mois
- 6-7 heures à 8 mois
- 7-9 heures à 9 mois
- 9-10 heures à 10 mois
- 10-11 heures à 11 mois
- 11-12 heures à 12 mois
Chaque enfant pouvant réagir différemment à cette condition, ces délais peuvent varier d'un individu à l'autre. La règle principale est de ne pas manquer le souper et le déjeuner.
Avec la diversification alimentaire, il est important de respecter désormais certains principes :
- Éviter la charcuterie et viande crue contenant plus de 10 g de gras par 100 g
- Préférer le lait écrémé et les fromages allégés en gras
- Manger des fruits et des légumes
- Le lait de coco, l'huile de palmiste et certains beurres sont très riches en Triglycéride à chaîne moyenne (MCT en anglais), et donc à éviter
- Les plats doivent contenir des sucres lents
- Éviter les fritures en alimentation quotidienne
Après 1 an
Après un an, les règles précédentes s'appliquent. Tout au long de leurs vies, les individus atteints de MCADD devront garder une alimentation saine et faible en gras. Les exceptions sont cependant tolérées.
L'apport énergétique
Durant les premiers mois de vie, le lait maternel et les préparations commerciales couvrent les besoins énergétiques de l'enfant. Jusqu'au 18 ans, les apports énergétiques issus du gras recommandé pour chaque individu varient de 25 % à 45 % en fonction de l'âge[8]. Pour les individus atteint de MCADD, il est recommandé de ne jamais dépasser les 30 %, peu importe l'âge[7].
Études
Entre 1994 et 2004, une étude a été faite en Australie sur 59 individus atteints de MCADD.[9]
Sur ces 59, 24 ont été diagnostiqués et suivis tandis que les 35 autres l'ont été ultérieurement.
Sur les 24 individus :
- 3 ont subi une décompensation sévère incluant un décès néonatal
- 21 ont suivi le traitement et n'ont eu aucun problème
Sur les 35 individus non diagnostiqués :
- 23 ont subi une décompensation sévère entrainant 5 décès
- 12 n'ont pas suivi le traitement et n'ont eu aucun problème
38 des 52 patients vivants ont effectué des tests neurophysiologiques, avec "Aucune suggestion de différences significatives dans les résultats cognitifs généraux entre les groupes"
En 2005, une autre étude a été faite aux Pays-Bas sur 155 individus allemands atteints de déficience en MCAD, âgés entre 3 mois et 5 ans.
Montrant des résultats similaires (mortalité élevée avant le diagnostic, risque d'atteintes neuronales lors des décompensations), celle-ci montre cependant une prédisposition aux personnes atteintes de MCADD à l'obésité et pour un tiers d'entre eux, à des troubles mineurs tels que la fatigue, des douleurs musculaires et une tolérance réduite à l'exercice[10].
Incidence
La population caucasienne d'Europe du Nord est la plus favorable d'être porteur de la déficience en MCADD.
Le déficit en MCAD a été considéré comme moins courant dans les populations hispaniques, afro-américaines et amérindiennes aux États-Unis. Cependant, cette vision a été corrigée par la mise en œuvre du dépistage des nouveau-nés pour la carence en MCAD. Les données disponibles de la Californie démontrent maintenant que la carence en MCAD peut être aussi répandue chez les Amérindiens (1: 7 500 naissances) que les natifs d'Europe du Nord, et les prévalences sont similaires chez les nouveau-nés d'origine hispanique, noire et du Moyen-Orient (1 : 23 000 naissances)[11].
Basé sur les nombreux pilotes de détection néonataux, l'incidence suivante a été établie[11] :
| Continent | Pays / État / Région | Incidence |
|---|---|---|
| Asie | 1:51 000 | |
| 1:263 500 | ||
| 1:18 000 | ||
| Océanie | 1:19 000 | |
| Europe | 1:24 900 | |
| 1:9 000 | ||
| 1:10 700 | ||
| 1:4 900 | ||
| 1:8 500 | ||
| 1:13 400 | ||
| 1:8 500 | ||
| 1:16 000 | ||
| 1:23 000 | ||
| 1:12 000 | ||
| 1:8 700 | ||
| Amérique du nord | 1:23 400 | |
| 1:19 000 | ||
| 1:15 000 | ||
| 1:14 000 | ||
| 1:19 000 | ||
| 1:13 000 | ||
| 1:15 700 |
Notes et références
- GeneCards Human Gene Database, « ACADM Gene - GeneCards | ACADM Protein | ACADM Antibody », sur www.genecards.org (consulté le 15 juillet 2017)
- « Dépistage néonatal : la France en retard », Le Figaro, (lire en ligne)
- « Vers l'élargissement du dépistage néonatal en France », Le Figaro, (lire en ligne)
- « Dépistage néonatal sanguin et urinaire : Services Québec – Citoyens », sur www4.gouv.qc.ca (consulté le 30 juillet 2017)
- (en) Claudia Soler-Alfonso, Michael J Bennett et Can Ficicioglu, « Screening for medium-chain acyl CoA dehydrogenase deficiency: current perspectives », Research and Reports in Neonatology, vol. 6, (DOI 10.2147/RRN.S60617, lire en ligne)
- (en) « Safe and unsafe duration of fasting for children with MCAD deficiency (PDF Download Available) », sur ResearchGate (consulté le 30 juillet 2017)
- (en) MCADD Guide of Juliane Marie Centre, Denmark (lire en ligne), p. 4
- « Dietary Recommendations for Healthy Children », sur www.heart.org (consulté le 30 juillet 2017)
- Bridget Wilcken, Marion Haas, Pamela Joy et Veronica Wiley, « Outcome of neonatal screening for medium-chain acyl-CoA dehydrogenase deficiency in Australia: a cohort study », Lancet (London, England), vol. 369, no 9555, , p. 37–42 (ISSN 1474-547X, PMID 17208640, DOI 10.1016/S0140-6736(07)60029-4, lire en ligne)
- (en) Terry G. J. Derks, Dirk-Jan Reijngoud, Hans R. Waterham et Willem-Jan M. Gerver, « The natural history of medium-chain acyl CoA dehydrogenase deficiency in the Netherlands: Clinical presentation and outcome », The Journal of Pediatrics, vol. 148, no 5, , p. 665–670.e3 (ISSN 0022-3476 et 1090-123X, PMID 16737882, DOI 10.1016/j.jpeds.2005.12.028, lire en ligne)
- Dietrich Matern et Piero Rinaldo, GeneReviews(®), University of Washington, Seattle, (PMID 20301597, lire en ligne)
Liens externes
- Portail de la médecine
- Portail de la biologie cellulaire et moléculaire