Busulfan
Le busulfan est un diester sulfonique utilisé comme anticancéreux dans le conditionnement préalable à une greffe de cellules souches hématopoïétiques. Son activité pharmacologique ne s'exerce que sur la moelle osseuse.
| Busulfan | |
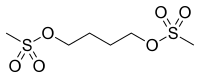 | |
| Identification | |
|---|---|
| DCI | busulfan |
| Nom UICPA | diméthanesulfonate de butane-1,4-diyle |
| No CAS | |
| No ECHA | 100.000.228 |
| No EC | 200-250-2 |
| Code ATC | L01 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C6H14O6S2 [Isomères] |
| Masse molaire[1] | 246,302 ± 0,018 g/mol C 29,26 %, H 5,73 %, O 38,98 %, S 26,04 %, |
| Propriétés physiques | |
| T° fusion | 287 °C déc |
| Précautions | |
| Classification du CIRC | |
| Groupe 1 : Cancérogène pour l'homme[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Historique
Au cours des années 1920, Louis S Goodman et Alfred Gilman, deux pharmacologues ont été embauchés par le département américain de la défense afin de travailler sur de possibles applications thérapeutiques des agents chimiques de combat, notamment les gaz moutarde employés pendant la Première Guerre mondiale. En 1942 à New Haven aux États-Unis a été testé pour la première fois sur un patient leucémique un dérivé de ces gaz utilisable par voie intraveineuse dénommé « moutardes à l'azote ». Divers composés myélosuppresseurs ont ensuite été utilisés avec succès en clinique sur des patients leucémiques pendant la guerre et publiés seulement à partir de 1946[3]. Par la suite, à la fin des années 1940 un chimiste anglais Alexander Haddow, et son équipe, David Galton, Eric Boyland, Walter Ross et George Timmis, ont entrepris un ambitieux programme de synthèse et d'étude de composés dérivés des moutardes à l'azote. De nombreuses molécules ont alors vu le jour telles l'uréthane, le busulfan (1953)[4], le chlorambucil et le melphalan[5],[6][réf. insuffisante]. Le busulfan a d'abord été utilisé par voie orale dans le traitement des leucémies myéloïdes chroniques, devenant le traitement de référence, avant d'être progressivement remplacé en 1re ligne par l'hydroxyurée dans les années 1960[4].
Dans les années 1990 des études ont été menées afin de tester le busulfan dans les conditionnements de greffe de cellules souches hématopoïétiques. Le busulfan étant une molécule très lipophile une forme galénique adaptée pour la voie intraveineuse n'était pas disponible. Le laboratoire français Pierre Fabre a mis au point une forme injectable et obtenu la première autorisation de mise sur le marché européen du busulfan sous le nom Busilvex en 2003 dans les conditionnements de greffe de cellules souches hématopoïétiques.
En mai 2017, la Commission européenne a annoncé qu'elle ouvrirait une enquête sur les pratiques tarifaires excessives auxquelles se serait livré Aspen Pharma, le laboratoire commercialisant la busulfan, dont le flacon de 25 comprimés coûte, en Angleterre en 2013, 65,22 livres sterlings au lieu de 5,20 livres lorsqu’il était commercialisé par GSK en 2009, soit une hausse de plus de 1100% en quatre ans[7],[8].
Mécanisme d'action
Le busulfan est un agent alkylant bifonctionnel à la différence des agents alkylants classiques monofonctionnels, induisant notamment une cytoxicité sur les cellules de la moelle osseuse.
| busulfan | |
| Noms commerciaux |
|
|---|---|
| Laboratoire | Aspri Pharma, Otsuka Pharmaceutical, laboratoires Pierre Fabre |
| Administration | per os (Myleran), perfusion (Busilvex) |
| Classe | antinéoplasiques, agents alkylants, alkylsulfonates, ATC code L01AB01 |
| Autres informations | Busilvex non disponible en ville |
Indications
Chez l'adulte
L'administration de busulfan suivie par du cyclophosphamide est indiqué comme traitement de conditionnement préalable à une greffe conventionnelle de cellules souches hématopoïétiques.
Le busulfan administré à la suite de fludarabine est indiqué comme traitement de conditionnement préalable à une greffe de cellules souches hématopoïétiques chez l’adulte éligible à un conditionnement à intensité réduite (RIC).
En pédiatrie
Le busulfan suivi par du cyclophosphamide ou du melphalan est indiqué comme traitement de conditionnement préalable à une greffe conventionnelle de cellules souches hématopoïétiques chez le nouveau-né, l’enfant et l'adolescent.
Pharmacocinétique
Le busulfan administré par voie intraveineuse est une molécule très hydrophobe, il est métabolisé principalement au niveau hépatique et excrété au niveau rénal.
Effets indésirables
Myélosuppression et immunosuppression.
Le busulfan est un agent mutagène et carcinogène.
Dose et suivi pharmacologique
Posologies
En association avec le cyclophosphamide (adultes) ou le melphalan (pédiatrie)
La posologie recommandée de busulfan est de 0,4 mg·kg-1 en perfusion intraveineuse sur deux heures toutes les six heures pendant quatre jours consécutifs soit un total de 16 doses suivi par deux cycles de cyclophosphamide au moins 24 heures après la dernière dose de busulfan afin d'éviter une interaction médicamenteuse entre les 2 composés en particulier une toxicité veino-occlusive et une mucite[9].
En association avec la fludarabine
Après administration de fludarabine la posologie recommandée de busulfan est de 3,2 mg·kg-1 en perfusion intraveineuse sur trois heures immédiatement après la fludarabine pendant deux à trois jours.
Suivi thérapeutique
Le dosage sanguin par HPLC/MS permet un suivi des concentrations avec un calcul de l'AUC dont la zone cible s'étend de 900 à 1500 µM/min. Une AUC inférieure à 900 µM/min est corrélée à des problèmes de greffe et des AUC supérieures à 1500 sont associées avec une toxicité hépatique de type veino-occlusif et de toxicité neurologique[10].
Contre-indications
- Hypersensibilité à la substance active ou à l'un des excipients (diméthylacétamide, Macrogol 400) ;
- grossesse.
Études cliniques
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme », sur monographs.iarc.fr, CIRC, (consulté le 22 août 2009)
- (en) « Nitrogen mustard therapy: Use of Methyl-Bis(Beta-Chloroethyl)amine Hydrochloride and Tris(Beta-Chloroethyl)amine Hydrochloride for Hodgkin's Disease, Lymphosarcoma, Leukemia and Certain Allied and Miscellaneous Disorders », JAMA,
- (en) DA Galton, « Myleran in chronic myeloid leukaemia; results of treatment », Lancet, vol. 264, no 6753, , p. 208-13. (PMID 13097987)
- (en) « Professor David Galton : Pioneer in leukaemia treatment », sur www.independent.co.uk, (consulté le 15 décembre 2014)
- (en) Myeloproliferative Disorders
- « Medscape France - Informations & Ressources médicales pour médecins | Medscape France », sur francais.medscape.com (consulté le 3 juin 2018).
- « Commission Européenne - COMMUNIQUES DE PRESSE - Communiqué de presse - Pratiques anticoncurrentielles: la Commission ouvre une procédure formelle d'examen sur les pratiques tarifaires d'Aspen Pharma concernant des médicaments contre le cancer », sur europa.eu (consulté le 3 juin 2018).
- « Busilvex, INN-Busulfan : Résumé des caractéristiques du produit » [PDF], sur www.ema.europa.eu (consulté le 15 décembre 2014)
- (en) Paci A, Veal G, Bardin C, Levêque D, Widmer N, Beijnen J, Astier A, Chatelut E, « Review of therapeutic drug monitoring of anticancer drugs part 1--cytotoxics », Eur J Cancer, vol. 50, no 12, , p. 2010-9. (PMID 24889915, DOI 10.1016/j.ejca.2014.04.014)
Liens externes
- Page spécifique dans la base de données sur les produits pharmaceutiques (Canada)
- Page spécifique sur le Centre belge d'information pharmacothérapeutique
- Compendium suisse des médicaments : spécialités contenant Busulfan
- Page spécifique sur le Vidal.fr
- Portail de la médecine
- Portail de la pharmacie
- Portail de la chimie