Zwitterion
Un zwitterion (prononcé [t͡svi.tɛ.rjɔ̃], de l'allemand Zwitter [ˈt͡svɪ.tɐ] « hybride », « hermaphrodite ») ou amphion est une espèce chimique moléculaire possédant des charges électriques formelles d’une unité, de signes opposés et situées en général sur des atomes non adjacents (dans le cas où les deux charges formelles sont portées par deux atomes adjacents, on parle d'ylures)[1]. Les acides aminés, qui possèdent des groupements amine (sous forme d'ammonium NH3+ à pH =7) et acide carboxylique (sous forme de carboxylate COO− à pH =7) peuvent exister sous forme zwitterionique (à l'état solide, dans certaines gammes de pH en solution aqueuse). Les bétaïnes[2] sont d'autres exemples de zwitterions.
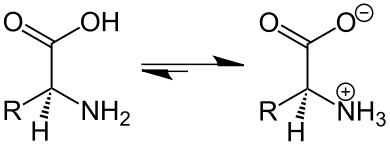
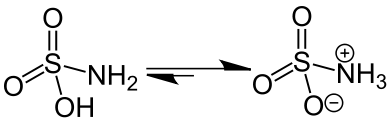
Comportement en fonction des variations de pH
L'état zwitterionique d'un composé est dépendant du pH. En effet, ces espèces ont tendance à capter ou à céder des ions H+ selon la valeur du pH de la solution aqueuse où ils se trouvent. Le zwitterion est à l'équilibre avec le cation et l'anion correspondant.
Chaque composé susceptible de former un zwitterion possède une valeur de pH caractéristique pour laquelle il est sous la forme zwitterionique globalement neutre : c'est le pH isoélectrique (ou pHi ou pI). En dehors de cette valeur, on aura :
| Cas où le pH est très inférieur au pI | Cas où le pH est voisin du pI | Cas où le pH est très supérieur au pI |
|---|---|---|
| Le composé se trouve majoritairement dans sa forme positive :
|
Le composé se trouve majoritairement sous sa forme zwitterionique :
|
Le composé se trouve majoritairement dans sa forme négative :
|
Le pH n'est pas forcément égal à une valeur de pH = 7 (pH neutre) et dépend du pKa des groupements chimiques constituant le composé.
Utilisations
Les composés pouvant former des zwitterions permettent la synthèse de solutions tampons. On obtient alors une solution tampon aux voisinages des pKa des différents groupements protonables constituants la molécule zwitterion. Le pH varie peu en cas de dilution modérée, ou en cas d'ajout d'une quantité limitée de H+ ou de OH−.
On peut assister à la formation des zwitterions lors de la synthèse de certains liquides ioniques. En effet, l'étape de quaternisation (d'un noyau imidazole par exemple) conduit à la formation d'un zwitterion. Ce dernier est protoné par un acide pour conduire au liquide ionique désiré.
Les zwitterions, du fait de la présence de charges électriques ponctuelles sont souvent solubles dans l'eau, donc de nombreux principes actifs de médicaments sont sous forme zwitterionique. Une espèce zwitterionique d'intérêt médical est la cétirizine (le principe actif du Zyrtec).
Ils ont également des applications domestiques, et entrent dans la composition de nombreux détergents.
Notes et références
- (en) « zwitterionic compounds/zwitterions », Compendium of Chemical Terminology [« Gold Book »], IUPAC, 1997, version corrigée en ligne : (2006-), 2e éd.
- (en) « betaines », Compendium of Chemical Terminology [« Gold Book »], IUPAC, 1997, version corrigée en ligne : (2006-), 2e éd.
Annexes
Article connexe
Lien externe
- La forme zwitterionique des acides aminés sur Chimie générale on-line
- Portail de la chimie