Taux de conversion
Le taux de conversion représente la fraction d'un réactif qui réagit lors d'une réaction chimique. Mathématiquement, le taux de conversion X pour un réactif i s'exprime pour un système fermé selon la formule suivante :
- ,
Ne doit pas être confondu avec taux de conversion (marketing).
où n est la quantité de matière (moles). Les indices o et t représentent respectivement l'état initial et un temps ultérieur donné.
Pour un système continu, comme une cuve agitée ou un réacteur tubulaire, le taux de conversion s'exprime de la même manière, à la différence près que les quantités n doivent être remplacées par des débits molaires :
Il est important de ne pas confondre le taux de conversion avec le rendement. Le taux de conversion renseigne uniquement sur la proportion de réactif qui a disparu, mais pas sur la quantité de produit formé qui, elle, dépend de la sélectivité.
Conversion et dimensionnement d'un réacteur
Travailler avec un haut taux de conversion permet généralement de maximiser le rendement ainsi que de simplifier les procédés de séparation et de purification ultérieures puisque le réactif se trouve presque épuisé. Cependant, cela demande de très long temps de réaction, ce qui a pour effet de diminuer la productivité volumétrique et donc a un effet négatif sur les coûts. En termes de dimensionnement, il s'agit donc souvent de trouver un compromis au niveau du taux de conversion afin de garder le temps de réaction ainsi que les procédés de séparation dans des limites acceptables de prix.
On peut montrer l'influence du taux de conversion sur le temps de réaction en utilisant par exemple un système fermé avec une réaction chimique de cinétique de premier ordre.
Le bilan de masse pour un tel système s'écrit :
Comme le système est fermé (pas d'entrée ni de sortie) il vient
Ce qui donne pour le réactif limitant :
Où est le volume du réacteur. Le terme de vitesse est ici négatif puisque le bilan est exprimé pour un réactif (qui donc disparaît).
En introduisant pour la vitesse de réaction l'expression donnée par la cinétique de premier ordre, soit :
Il devient:
Ou en développant:
En admettant un volume constant on peut simplifier l'expression en :
Il est facile de montrer qu'à partir de la définition du taux de conversion plus haut on peut exprimer la concentration du réactif limitant au temps t comme étant :
En substituant cette expression on obtient :
Cette équation différentielle s'intègre facilement par séparation des variables :
Comme la constant de vitesse et la concentration initiale peuvent être sorties de l'intégrale on obtient l'expression suivante qui relie le taux de conversion final au temps de réaction :
En choisissant arbitrairement une constante de vitesse hypothétique de 1 on peut obtenir la courbe montrée en figure 1 qui donne le temps de réaction nécessaire pour obtenir un taux de conversion donné.
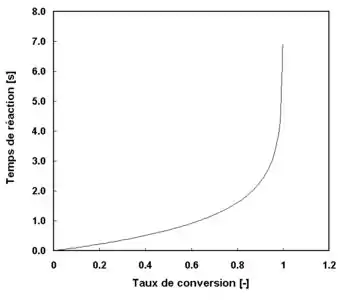
On remarque sur la figure 1 qu'il faut environ avec cette constante hypothétique 1,6 seconde pour atteindre 80 % de conversion, et 3 secondes pour atteindre 95 %. Cela veut dire qu'il faut deux fois plus de temps pour réaliser ces 15 % (entre 95 et 80 %) que pour compléter les 4/5 de la réaction. D'autre part, on remarque que l'on atteint jamais avec une telle cinétique une conversion de 100 %.
En termes de dimensionnement, cela a pour conséquence qu'il n'est pas judicieux de pousser la réaction au maximum, puisque le temps nécessaire pour accomplir la réaction tend alors vers l'infini.
À noter que pour un réacteur continu, un long temps de réaction implique un long temps de séjour, ce qui nécessite un grand volume.
Il est important de réaliser que tout le développement mené ici n'est valable que pour une réaction chimique avec une cinétique de premier ordre. Si l'ordre est plus élevé, l'effet est plus accentué et il est encore plus dur d'atteindre des hauts taux de conversion. Une grande partie des réactions chimiques se déroulent avec des ordres égaux ou supérieurs à un, ce qui justifie l'exemple choisi ici.
Pour une cinétique d'ordre zéro, le taux de conversion augmente linéairement avec le temps, alors que pour des réactions avec des cinétiques plus complexes, comme celles impliquant une catalyse enzymatique ou des microorganismes, la relation entre le taux de conversion et le temps de réaction peut être bien différente.
Bibliographie
- Chemical Reaction Engineering, 3rd Edition, by Octave Levenspiel, John Wiley & Sons (1999)
Notes et références
- Portail de la chimie