Respirasome
Un respirasome, ou supercomplexe, est un assemblage d'enzymes de la chaîne respiratoire mitochondriale formant une structure supramoléculaire englobant deux ou trois des complexes respiratoires I, III et IV — respectivement la NADH déshydrogénase, la coenzyme Q-cytochrome c réductase et la cytochrome c oxydase. L'existence de ce type de structures est fortement suggérée par un certain nombre d'observations peu compatibles avec le modèle initial décrivant les complexes respiratoires comme individualisés et se distribuant de manière fluide dans la membrane. Ces supercomplexes apparaissent comme nécessaires à la formation de complexes respiratoires stables et fonctionnellement actifs[2]. Ils ont été observés dans un grand nombre d'espèces et de tissus différents, notamment dans le cerveau, le foie, les reins, les muscles squelettiques[3] et le cœur chez le rat[4], le cœur chez le bœuf[5], les fibroblastes de la peau humaine[6], les mycètes[7], les plantes[8],[9], et le nématode Caenorhabditis elegans[10].
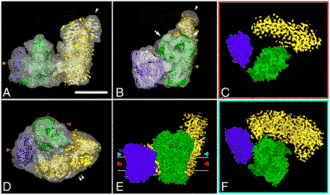
Les premiers supercomplexes, formés des complexes III et IV, ont été identifiés dès 1985 à partir de bactéries[11],[12],[13] et de levures[14],[15]. Des supercomplexes formés des complexes I, III et IV ont également été observés en 2000 à partir de membranes mitochondriales internes bovines par une technique d'électrophorèse des protéines[16].
Composition et dynamique
Les supercomplexes les plus couramment observés sont formés des complexes I / III, I / III / IV et III / IV. Les complexes II — succinate déshydrogénase — sont généralement observés sous forme libre dans les mitochondries à la fois de plantes et d'animaux. De même, l'ATP synthase est rarement observée comme partie intégrante d'un supercomplexe[2].
L'assemblage des supercomplexes paraît être dynamique, les enzymes respiratoires fluctuant entre un état lié à un respirasome et un état dissocié dans lequel elles diffusent librement dans la membrane mitochondriale interne. On ignore précisément ce qui déclenche le passage de l'état lié à l'état dissocié, mais on a observé que la formation des supercomplexes est fortement liée à la composition de la bicouche lipidique de la membrane mitochondriale interne, et requiert en particulier la présence de cardiolipine, un lipide membranaire particulier[17]. Le nombre de supercomplexes observés dans les mitochondries de levures dépourvues de cardiolipine est significativement réduit[17],[18]. La cardiolipine agirait en neutralisant la charge des résidus de lysine des domaines en interaction des complexes III et IV, ce qui stabiliserait la formation du supercomplexe correspondant[19]. Une autre hypothèse expliquant la formation des supercomplexes fait appel au potentiel électrochimique de membrane, qui modifierait les interactions électrostatiques et hydrophobes à l'œuvre dans l'assemblage des supercomplexes[20].
Signification fonctionnelle
La signification fonctionnelle des respirasomes n'est pas encore très claire. Il a été proposé que cette organisation des enzymes respiratoire limite les dommages dus aux dérivés réactifs de l'oxygène et optimise l'efficacité de la chaîne respiratoire. On a montré en 2006 que les complexes I et III présentent une activité catalytique accrue lorsqu'ils forment un supercomplexe comprenant le complexe IV, ce qui tendrait à montrer que la présence de ce complexe favoriserait leur efficacité catalytique[21]. De nombreuses observations ont également mis en évidence l'importance des respirasomes pour la stabilité et l'efficacité du complexe I[20]. Ils pourraient également optimiser l'utilisation des substrats par les enzymes respiratoires[22].
Notes et références
- (en) Natalya V. Dudkina, Mikhail Kudryashev, Henning Stahlberg et Egbert J. Boekema, « Interaction of complexes I, III, and IV within the bovine respirasome by single particle cryoelectron tomography », Proceedings of the National Academy of Sciences of the United States of America, vol. 108, no 37, , p. 15196-15200 (PMID 21876144, PMCID 3174662, DOI 10.1073/pnas.1107819108, JSTOR 41352069, Bibcode 2011PNAS..10815196D, lire en ligne)
- (en) Rasika Vartak, Christina Ann-Marie Porras et Yidong Bai, « Respiratory supercomplexes: structure, function and assembly », Review Protein & Cell, vol. 4, no 8, , p. 582-590 (PMID 23828195, DOI 10.1007/s13238-013-3032-y, lire en ligne)
- (en) A. Lombardi, E. Silvestri, F. Cioffi, R. Senese, A. Lanni, F. Goglia, P. de Lange et M. Moreno, « Defining the transcriptomic and proteomic profiles of rat ageing skeletal muscle by the use of a cDNA array, 2D- and Blue native-PAGE approach », Journal of Proteomics, vol. 72, no 4, , p. 708-721 (PMID 19268720, DOI 10.1016/j.jprot.2009.02.007, lire en ligne)
- (en) Nicole H. Reifschneider, Sataro Goto, Hideko Nakamoto, Ryoya Takahashi, Michiru Sugawa, Norbert A. Dencher et Frank Krause, « Defining the Mitochondrial Proteomes from Five Rat Organs in a Physiologically Significant Context Using 2D Blue-Native/SDS-PAGE », Journal of Proteome Research, vol. 5, no 5, , p. 1117-1132 (PMID 16674101, DOI 10.1021/pr0504440, lire en ligne)
- (en) Eva Schäfer, Norbert A. Dencher, Janet Vonck et David N. Parcej, « Three-Dimensional Structure of the Respiratory Chain Supercomplex I1III2IV1 from Bovine Heart Mitochondria », Biochemistry, vol. 46, no 44, , p. 12579-12585 (PMID 17927210, DOI 10.1021/bi700983h, lire en ligne)
- (en) Frank Krause, Christian Q. Scheckhuber, Alexandra Werner, Sascha Rexroth, Nicole H. Reifscheider, Norbert A. Dencher et Heinz D. Osiewacz, « OXPHOS Supercomplexes. Respiration and Life-Span Control in the Aging Model Podospora anserina », Annals of the New York Academy of Sciences, vol. 1067, , p. 106-115 (PMID 16803975, DOI 10.1196/annals.1354.013, Bibcode 2006NYASA1067..106K, lire en ligne)
- (en) Holger Eubel, Jesco Heinemeyer, Stephanie Sunderhaus et Hans-Peter Braun, « Respiratory chain supercomplexes in plant mitochondria », Plant Physiology and Biochemistry, vol. 42, no 12, , p. 937-942 (PMID 15707832, DOI 10.1016/j.plaphy.2004.09.010, lire en ligne)
- (en) Stephanie Sunderhaus, Jennifer Klodmann, Christof Lenz et Hans-Peter Braun, « Supramolecular structure of the OXPHOS system in highly thermogenic tissue of Arum maculatum », Plant Physiology and Biochemistry, vol. 48, no 4, , p. 265-272 (PMID 20144873, DOI 10.1016/j.plaphy.2010.01.010, lire en ligne)
- (en) Wichit Suthammarak, Benjamin H. Somerlot, Elyce Opheim, Margaret Sedensky et Philip G. Morgan, « Novel interactions between mitochondrial superoxide dismutases and the electron transport chain », Aging Cell, vol. 12, no 6, , p. 1132-1140 (PMID 23895727, PMCID 3838459, DOI 10.1111/acel.12144, lire en ligne)
- (en) E. A. Berry et B. L. Trumpower, « Isolation of ubiquinol oxidase from Paracoccus denitrificans and resolution into cytochrome bc1 and cytochrome c-aa3 complexes », Journal of Biological Chemistry, vol. 260, no 4, , p. 2458-2467 (PMID 2982819, lire en ligne)
- (en) Toshio Iwasaki, Katsumi Matsuura et Tairo Oshima, « Resolution of the Aerobic Respiratory System of the Thermoacidophilic Archaeon, Sulfolobus sp. Strain 7: I. The archaeal terminal oxidase supercomplex is a functional fusion of respiratory complexes III and IV with no c-type cytochromes », Journal of Biological Chemistry, vol. 270, no 52, , p. 30881-30892 (PMID 8537342, DOI 10.1074/jbc.270.52.30881, lire en ligne)
- (en) N. Sone, M. Sekimachi et E. Kutoh, « Identification and properties of a quinol oxidase super-complex composed of a bc1 complex and cytochrome oxidase in the thermophilic bacterium PS3 », Journal of Biological Chemistry, vol. 262, no 32, , p. 15386-15391 (PMID 2824457, lire en ligne)
- (en) Hans Boumans, Leslie A. Grivell et Jan A. Berden, « The Respiratory Chain in Yeast Behaves as a Single Functional Unit », Journal of Biological Chemistry, vol. 273, no 9, , p. 4872-4877 (PMID 9478928, DOI 10.1074/jbc.273.9.4872, lire en ligne)
- (en) Christophe Bruel, Robert Brasseur et Bernard L. Trumpower, « Subunit 8 of the Saccharomyces cerevisiae cytochrome bc1 complex interacts with succinate-ubiquinone reductase complex », Journal of Bioenergetics and Biomembranes, vol. 28, no 1, , p. 59-68 (PMID 8786239, DOI 10.1007/BF02109904, lire en ligne)
- (en) Hermann Schägger et Kathy Pfeiffer, « Supercomplexes in the respiratory chains of yeast and mammalian mitochondria », The EMBO Journal, vol. 19, no 8, , p. 1777-1783 (PMID 10775262, PMCID 302020, DOI 10.1093/emboj/19.8.1777, lire en ligne)
- (en) Mei Zhang, Eugenia Mileykovskaya et William Dowhan, « Gluing the respiratory chain together. Cardiolipin is required for supercomplex formation in the inner mitochondrial membrane », Journal of Biological Chemistry, vol. 277, no 46, , p. 43553-43556 (PMID 12364341, DOI 10.1074/jbc.C200551200, lire en ligne)
- (en) Mei Zhang, Eugenia Mileykovskaya et William Dowhan, « Cardiolipin Is Essential for Organization of Complexes III and IV into a Supercomplex in Intact Yeast Mitochondria », Journal of Biological Chemistry, vol. 280, no 33, , p. 29403-29408 (PMID 15972817, PMCID 4113954, DOI 10.1074/jbc.M504955200, lire en ligne)
- (en) Tina Wenz, Ruth Hielscher, Petra Hellwig, Hermann Schägger, Sebastian Richers et Carola Hunte, « Role of phospholipids in respiratory cytochrome bc1 complex catalysis and supercomplex formation », Biochimica et Biophysica Acta (BBA) - Bioenergetics, vol. 1787, no 6, , p. 609-616 (PMID 19254687, DOI 10.1016/j.bbabio.2009.02.012, lire en ligne)
- (en) Giorgio Lenaz et Maria Luisa Genova, « Supramolecular Organisation of the Mitochondrial Respiratory Chain: A New Challenge for the Mechanism and Control of Oxidative Phosphorylation », Mitochondrial Oxidative Phosphorylation, vol. 748, , p. 107-144 (PMID 22729856, DOI 10.1007/978-1-4614-3573-0_5, lire en ligne)
- (en) Eva Schäfer, Holger Seelert, Nicole H. Reifschneider, Frank Krause, Norbert A. Dencher et Janet Vonck, « Architecture of Active Mammalian Respiratory Chain Supercomplexes », Journal of Biological Chemistry, vol. 281, no 22, , p. 15370-15375 (PMID 16551638, DOI 10.1074/jbc.M513525200, lire en ligne)
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire