Oxyde de cobalt(II)
L'oxyde de cobalt(II), ou monoxyde de cobalt, est un composé chimique de formule CoO. Il s'agit d'un solide se présentant sous forme de cristaux rouges à vert-olive ou de poudre grise à noire. Il possède une bande interdite d'environ 2,4 eV. Il est très utilisé comme additif dans l'industrie de la céramique pour produire des émaux et des glaçures bleus ainsi que dans l'industrie chimique pour produire des sels de cobalt (II).
| Oxyde de cobalt(II) | |
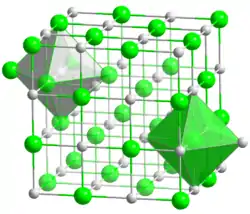 __ Co2+ __ O2− Maille cristalline de l'oxyde de cobalt(II) |
|
| Identification | |
|---|---|
| Nom UICPA | oxocobalt |
| Synonymes |
monoxyde de cobalt, |
| No CAS | |
| No ECHA | 100.013.777 |
| No CE | 215-154-6 |
| PubChem | 14786 |
| SMILES | |
| InChI | |
| Apparence | cristaux rouge à vert-olive, poudre grise à noire |
| Propriétés chimiques | |
| Formule | CoO [Isomères] |
| Masse molaire[1] | 74,9326 ± 0,0003 g/mol Co 78,65 %, O 21,35 %, |
| Propriétés physiques | |
| T° fusion | 1 935 °C[2] |
| Solubilité | 3,13 mg·l-1[2] |
| Masse volumique | 5,7 à 6,7 g/cm3[2] selon la préparation |
| Précautions | |
| SGH[2],[3] | |
   Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
L'oxyde de cobalt(II) adopte la maille cristalline du sel gemme, avec un paramètre cristallin de 426,15 pm[4]. Il est antiferromagnétique en dessous de 16 °C[5].
L'oxyde de cobalt(II,III) Co3O4 se décompose en oxyde de cobalt(II) à 950 °C :
L'oxyde de cobalt(II) est disponible dans le commerce mais peut également être préparé en laboratoire par électrolyse d'une solution de chlorure de cobalt(II) CoCl2 :
Il peut également être préparé par précipitation de l'hydroxyde, suivie d'une décomposition thermique :
- CoX + 2 NaOH → Co(OH)2 + Na2X,
- Co(OH)2 → H2O + CoO.
Comme on peut s'y attendre, l'oxyde de cobalt(II) réagit avec les acides minéraux pour former les sels correspondants du cobalt :
- CoO + 2 HX → CoX2 + H2O.
L'oxyde de cobalt(II) est utilisé depuis des siècles pour colorer la céramique cuite au four. Il procure une coloration bleue profonde appelée bleu de cobalt ou smalt.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Cobalt(II) oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 février 2013 (JavaScript nécessaire)
- (en) R. Kannan et Mohindar S. Seehra, « Percolation effects and magnetic properties of the randomly diluted fcc system CopMg1-pO », Physical Review B, vol. 35, no 13, , p. 6847-6853 (lire en ligne) DOI:10.1103/PhysRevB.35.6847
- (en) P. S. Silinsky et Mohindar S. Seehra, « Principal magnetic susceptibilities and uniaxial stress experiments in CoO », Physical Review B, vol. 24, no 1, , p. 419-423 (lire en ligne) DOI:10.1103/PhysRevB.24.419
- Portail de la chimie
