Matériau superdur
Un matériau est qualifié de superdur, ou d'ultradur, quand sa dureté Vickers dépasse 40 gigapascals[1],[2],[3],[4]. Ce sont des solides très peu compressibles, à forte densité électronique et présentant des liaisons chimiques fortement covalentes. En raison de leurs propriétés uniques, ces matériaux sont d'un grand intérêt pour beaucoup d'applications industrielles, dont les abrasifs, les outils de découpe et de polissage, ou les revêtements de protection.
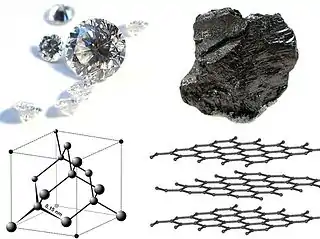
Le diamant est l'un des matériaux les plus durs connus à ce jour, avec une dureté Vickers dans la gamme des 70-150 GPa (en 2009 une équipe internationale de recherche a montré que la lonsdaléite peut supporter une pression 58 % supérieure au diamant[5]). Il possède à la fois une bonne conductivité thermique et une faible conductivité électrique. Beaucoup d'efforts ont été déployés pour exploiter ses propriétés. Cependant, le diamant souffre de plusieurs inconvénients dont son coût élevé et ses problèmes d'oxydation au-dessus de 800 °C[6],[7]. De plus, il est soluble dans le fer et forme des carbures de fer à hautes températures ; il est donc inexploitable pour la découpe des matériaux ferreux, dont l'acier. C'est pourquoi les recherches sur les matériaux superdurs se sont concentrées sur le développement de composés plus stables thermiquement et chimiquement que le diamant pur.
Les matériaux superdurs sont en général classés en deux catégories : les intrinsèques et les extrinsèques. Le groupe des intrinsèques comprend le diamant, le nitrure de bore cubique (c-BN), les nitrures de carbone et les composés ternaires B-N-C qui sont naturellement durs à l'état massif. À l'inverse, la dureté et les autres propriétés mécaniques des extrinsèques sont déterminées par leur microstructure plus que par leur composition chimique[8],[9],[10]. Le diamant nanocristallin sous forme de nanopilier est un exemple de matériau superdur extrinsèque.
Les matériaux superdurs ne peuvent souvent être synthétisés que dans ces conditions de hautes températures et hautes pressions. Le développement de méthodes de synthèse à moindre coût font partie des activités de recherche dans ce domaine[9],[10].
Définitions et mesures de la dureté
En science des matériaux, il existe des définitions et des protocoles de mesure précis qui permettent de quantifier la notion intuitive de « dureté ». Dans le cas des matériaux dits « ultradurs », on s'intéresse en général non seulement à la dureté elle-même, mais également à d'autres propriétés mécaniques du matériau : les modules élastiques qui caractérisent son comportement élastique, et la ténacité qui caractérise sa résistance à la fracture. Ces différentes propriétés sont plus ou moins corrélées mais néanmoins bien distinctes, et permettent une caractérisation plus complète du matériau.
Échelles de dureté


Historiquement, la dureté a d'abord été définie par la capacité d'un matériau à en rayer un autre, et quantifiée par un nombre entier ou parfois demi-entier ; c'est l'échelle de Mohs. Mais le caractère trop discret et non linéaire de cette échelle fut rapidement mis en évidence.
La mesure de la dureté est aujourd'hui faite selon plusieurs échelles dont les principales sont les échelles de Vickers, de Brinell, de Rockwell, de Knoop. Les détails du protocole et les domaines d'applications varient d'une échelle à l'autre, mais le principe est toujours le même : on appuie avec un « pénétrateur » sur le matériau à tester avec une force donnée. La valeur de la dureté se déduit alors de la taille de l'empreinte laissée par le pénétrateur dans le matériau. Le pénétrateur doit être réalisé dans un matériau beaucoup plus dur que le matériau à tester, typiquement le diamant.
L'échelle de Vickers est aujourd'hui largement acceptée comme le test le plus courant[10]. La mesure se fait avec une pointe pyramidale normalisée en diamant de base carrée et d'angle au sommet entre faces égal à 136°. La force et la durée de l'appui sont également normalisées. L'empreinte a donc la forme d'un carré ; on mesure les deux diagonales et de ce carré à l'aide d'un appareil optique. On obtient la valeur en effectuant la moyenne de et . C'est qui sera utilisé pour le calcul de la dureté notée selon la relation
avec = dureté Vickers
= force appliquée [N]
= moyenne des diagonales de l'empreinte [mm]
Cependant, la mesure de la dureté des matériaux ultradurs peut être particulièrement délicate si celle-ci approche voire dépasse la dureté du matériau du pénétrateur. Il est alors facile de faire des erreurs d'interprétation et un soin particulier doit être apporté à la mesure. Celle-ci doit être réalisée à plusieurs reprises avec des chargements différents, et c'est le comportement asymptotique pour les forts chargements qui est considéré comme la valeur de dureté, c'est-à-dire la valeur obtenue quand le régime de déformation plastique est pleinement établi. Sans ces précautions, la dureté peut-être facilement surestimée[11].
| Matériau | Diamant | BC2Nc | BNc | OsB2 | B4C | ReB2 |
|---|---|---|---|---|---|---|
| Dureté Vickers (GPa) | 115 | 76 | 48 | 37 | 30 | 22 |
Propriétés élastiques
L'incompressibilité d'un matériau est quantifiée par son module d'incompressibilité isostatique, noté en général ou , qui mesure sa résistance à un changement de volume sous l'effet d'une pression isostatique. Il est défini par , où V est le volume et P la pression. La mesure de ce module peut aussi être réalisée avec un indenteur. Les éléments avec un faible volume molaire et de grands forces interatomiques ont habituellement un fort module d'incompressibilité. Ce test fut le premier test à être utilisé comme mesure de dureté. Il a été montré qu'il était corrélé avec le volume molaire et l'énergie de cohésion par . On a cru que le module d'incompressibilité pouvait être utilisé comme une mesure directe de la dureté, mais cette idée est maintenant pratiquement abandonnée. Par exemple, les alcalins et les métaux nobles (Pd, Ag) ont des rapports anormalement élevés entre le module d'incompressibilité et la dureté Vickers ou Brinell. Au début des années 2000, une relation directe entre le module d'incompressibilité et la densité d'électrons de valences a été mise en évidence : plus il y a d'électrons de valences, plus ils exercent entre deux des forces répulsives dans la structure[9]. Le module d'incompressibilité est toujours utilisé comme une mesure préliminaire de la superdureté d'un matériau, mais il est maintenant bien connu que d'autres propriétés doivent être prises en compte[9],[10]. Les matériaux durs ont un fort module d'incompressibilité, mais réciproquement un fort module d'incompressibilité ne signifie pas nécessairement que le matériau est dur.
Contrairement au module d'incompressibilité, le module de cisaillement mesure la résistance d'un matériau à une changement de forme sans changement de volume sous l'effet d'une contrainte de cisaillement. Il est défini comme le rapport entre la contrainte et la déformation en cisaillement par où F est la force appliquée, A est la surface sur laquelle la force s'applique, dx est le déplacement résultant et L est la longueur initiale. Le module de cisaillement est relié au module d'incompressibilité isostatique via le coefficient de poisson via la relation 3/G = 2B·(1–2v)·(1+v). Pour les matériaux covalents, le coefficient de Poisson est typiquement de l'ordre de 0,1. Si un matériau contient des liaisons chimiques très directionnelles, il aura un module de cisaillement élevé et un coefficient de Poisson faible. Le module de cisaillement peut présenter une meilleure corrélation avec la dureté que le module d'incompressibilité.
Ténacité
La ténacité, c'est-à-dire la capacité d'un matériau à résister à la fracture sous l'effet d'un choc, est également liée à la dureté. Toutefois, un matériau superdur n'est pas nécessairement « supertenace ». Par exemple, la ténacité du diamant est d'environ 7-10 MPa·m1/2[14],[15], ce qui est grand par rapport à d'autres pierres fines ou à des céramiques, mais faible comparé à beaucoup de métaux et d'alliages - l'acier et les alliages d'aluminium ont des valeurs de ténacité au moins cinq fois plus grandes[16].
Les matériaux covalents ont en général de grandes constantes de raideur associée à la flexion des liaisons chimiques et un fort module de cisaillement ; ils sont des matériaux en général plus durs que, par exemple, les solides ioniques[9],[10].
Un matériau est également considéré superdur s'il résiste à la déformation plastique. Dans un matériau avec des liaisons covalentes courtes, les dislocations mises en jeu dans une déformation plastique se forment moins facilement que dans des matériaux aux liaisons longues ou délocalisées. Si un matériau contient des liaisons délocalisées, alors il sera probablement mou[9].
Diamant
Le diamant est un allotrope du carbone dans lequel les atomes sont arrangés selon une version modifiée d'un réseau cubique à faces centrées (fcc) appelée structure diamant. Il est connu pour sa dureté, son incompressibilité et fait l'objet de recherche en vue d'applications possibles pour ses propriétés optiques et électriques. Les propriétés du diamant naturel étant trop variables pour les besoins de l'industrie, la fabrication de diamant synthétique est devenue un thème de recherche majeur[17],[18].
Diamant synthétique
La synthèse de diamant sous hautes pressions en 1953 en Suède[19],[20] et en 1954 aux États-Unis[21], permise par le développement de nouvelles techniques et instruments, fut un jalon important pour la synthèse de matériaux superdurs. Cette synthèse démontra clairement le potentiel des hautes pressions pour les applications industrielles, et stimula l'intérêt pour ce domaine de recherche. Quatre ans après la première synthèse de diamant artificiel, le nitrure de bore cubique c-BN fut fabriqué, et devient le deuxième matériau le plus dur[22].
Le diamant synthétique existe sous forme de monocristal, ou sous forme polycristalline, avec plusieurs grains séparés par des joints de grain. Les grains sont visibles à l'œil nu à cause des propriétés d'absorption et de diffusion de la lumière[23]. La dureté du diamant de synthèse est comprise entre 70 et 150 GPa ; elle dépend très fortement de la pureté du cristal. Plus la structure contient de défauts, moins le diamant est dur. Il a été montré que le diamant de synthèse, soit sous forme monocristalline ou sous forme d'agrégat, fabriqué à hautes pressions et hautes températures peut être plus dur que le diamant naturel[23].
Historiquement, on pensait que le diamant synthétique devait être structuralement parfait pour être utile. Ceci vient du fait que le diamant était surtout prisé pour ses qualités esthétiques, et que les petits défauts de structure ou de composition sont visibles à l’œil nu. Bien que ce soit vrai, les propriétés associées à de petits changement ont conduit à des applications nouvelles et intéressantes du diamant synthétique. Par exemple, doper le diamant à l'azote permet d'améliorer les propriétés mécaniques[24]. D'autre part, quand il est fortement dopé au bore (quelques pourcents), il devint un supraconducteur covalent[25].
Nitrure de bore cubique
-3D-balls.png.webp)
Synthèse
Le nitrure de bore cubique c-BN fut synthétisé pour la première fois en 1957 par Robert H. Wentorf (en) à General Electric, peu de temps après la synthèse du premier diamant artificiel[22]. Le procédé générique pour cette synthèse est la dissolution du nitrure de bore hexagonal (h-BN) dans un solvant catalyseur, habituellement un alcalin, un alcalino-terreux ou leur nitrure, suivi d'une nucléation spontanée de c-BN dans des conditions de hautes températures et de hautes pressions[10]. Le rendement d'une synthèse est plus bas, et la synthèse est globalement plus lente que le diamant en raison de la complexité des étapes intermédiaires.
Le nitrure de bore cubique pur est transparent ou légèrement ambré. Il peut avoir différentes couleurs avec un excès ou un défaut de bore (moins de 1 %)[10]. Les défauts peuvent être produits en dopant le solvant-catalyseur (par exemple le nitrure de Mg, Ca ou Li) avec Al, B, Ti ou Si. Ceci provoque un changement de morphologie et de couleur du cristal[26] ; les cristaux sont plus opaques, plus grands (500 µm), ils ont de meilleures formes, et le rendement de la synthèse est meilleur.
Structure et propriétés
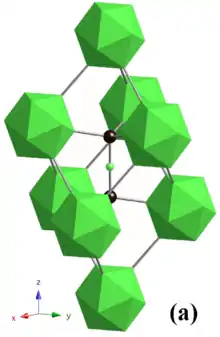
Le nitrure de bore cubique adopte une structure sphalérite. La longueur de la liaison courte B-N (1,57 Å) est très voisine de celle de la liaison C-C du diamant (1,54 Å), ce qui a pour résultat une liaison fortement covalente, de même que dans le diamant. Elles sont légèrement moins covalentes dans B-N, ce qui réduit la dureté de 100 GPa environ pour le diamant à 48 GPa pour c-BN. De même que le diamant est moins stable que le graphite, c-BN est moins stable que la forme hexagonale h-BN, mais le taux de conversion d'une phase à une autre est négligeable à température ambiante[27].
Son insolvabilité dans le fer et d'autres métaux en font un matériau plus utile que le diamant pour certaines applications[27].
Le nitrure de bore cubique est insoluble dans le fer, le nickel et les alliages apparentés, mais il forme facilement des liaisons avec les métaux à cause de la formation de couches intermédiaires de nitrures et de borures métalliques. Il est également insoluble dans la plupart des acides, il est soluble dans les sels fondus d'alcalins tels que LiOH, KOH, NaOH/Na2CO3 ou NaNO3 qui sont utilisés pour l'attaque chimique de c-BN[28]. Grâce à sa stabilité thermique et chimique avec les métaux, c-BN surpasse le diamant dans les applications mécaniques. La conductivité thermique de c-BN est parmi les plus grandes de tous les isolants électriques. De plus, c-BN n'est formé que d'éléments légers, et absorbe donc très faiblement les rayons X, ce qui est intéressant pour la fabrication de membranes et de masques pour rayons X[29].
Recherche et développement
Avec ses excellentes propriétés chimiques et mécaniques, c-BN a une large gamme d'applications pour les abrasifs, les outils de découpe, et est même un des matériaux privilégiés pour les fenêtres à rayons X - ici ses propriétés mécaniques permettent de réduire l'épaisseur de la fenêtre sans la casser, ce qui limite l'absorption des rayons X. Plusieurs centaines de tonnes de c-BN sont produites chaque année[30]. Le Bozaron, une marque commerciale américaine du c-BN, est utilisée dans l'industrie pour le façonnage d'outils, car il supporte des températures supérieures à 2 000 °C. Des meules de broyages avec un revêtement de c-BN, appelée meules Borazon, sont couramment utilisées pour l'usinage de métaux ferreux durs, de fers trempés, et de superalliages à base de nickel ou de cobalt. Il est également commercialisé sous d'autres marques, telles que Elbor ou Cubonite, par des vendeurs russes[27].
Les nouvelles approches de recherche se concentrent sur l'amélioration des procédés de synthèse[10]. Actuellement, les instruments de synthèse sont limités à 6 GPa. Augmenter cette gamme de pression permettra la synthèse de monocristaux plus grands que par les synthèses actuelles par catalyse. L'utilisation de solvants dans des conditions supercritiques permet de réduire la pression nécessaire[10].
Le coût élevé de c-BN limite encore ses applications ce qui motive le développement d'autres matériaux superdurs.
Nitrure de carbone
La structure du nitrure de carbone C3N4 fut proposée théoriquement en 1985. Ce composé, isostructural avec Si3N4, était selon les calculs plus dur que le diamant[31], avec une liaison chimique de 1,47 Å, de 5 % plus courte que la liaison C-C du diamant. Des calculs ultérieurs prédirent que le module de cisaillement était de 40 % inférieur à celui du diamant et que le nitrure de carbone était moins dur que le nitrure de bore c-BN[32].
Malgré deux décennies de tentatives, aucun échantillon n'a confirmé les prédictions de dureté, ce qui est attribué à la difficulté de la synthèse et l'instabilité du composé. Le nitrure de carbone n'est stable qu'à des pressions supérieures à celle de la transformation graphite-diamant. Les conditions de synthèses réclament alors des pressions extrêmement élevées car le carbone a une coordination de quatre ou six[10]. De plus, C3N4 poserait des problèmes de formations de carbures s'il était utilisé pour l'usinage de matériaux ferreux. Bien que la synthèse de C3N4 ait été rapportée, la démonstration de sa superdureté n'a pas été faite[33].
Nitrures de bore et de carbone
Les rayons atomiques semblables du bore, du carbone et de l'azote, ainsi que l'existence de polymorphes semblables du carbone et du nitrure de bore suggèrent la possibilité de synthétiser des phases de structure similaire contenant les trois éléments. Il est également possible de faire des composés de type B-C-O, B-O-N ou B-C-O-N sous hautes pressions, mais leur synthèse demanderait une chimie complexe, et de plus, leurs propriétés élastiques seraient a priori inférieures à celles du diamant.
Au début des années 1990, beaucoup d'efforts ont été consacrés à l'étude de la faisabilité de la synthèse de phases B-C-N denses. On s'attend à ce qu'elles soient plus stables chimiquement et thermiquement que le diamant, et plus dures que c-BN, ce qui en feraient d'excellents matériaux pour la découpe à grande vitesse et le polissage d'alliages ferreux. Ces propriétés sont expliquées par une structure semblable à celle du diamant combinée avec les liaisons chimiques sp3 que forme le carbone avec les autres atomes.
Des couches minces de BCxNy ont été synthétisées par dépôt chimique en phase vapeur en 1972[34]. Cependant, les données présentées par différents auteurs sur ces tentatives de synthèses de phases denses sont contradictoires. La nature exacte des produits de ces synthèses n'a pas été tranchée, entre des solutions solides de carbone et de BN de structure diamant, ou un mélange de diamant fortement dispersé dans c-BN. En 2001, c-BC2N de structure semblable au diamant a été synthétisée à des pressions et températures supérieures à 18 GPa et 2 200 K respectivement par une réaction en phase solide de (BN)0,48C0,52 de structure graphite. Les duretés Vickers et Knoop rapportées sont intermédiaires entre celles du diamant et de c-BN, ce qui en ferait le second matériau le plus dur[35]. Des phases B-C-N ternaires peuvent également être réalisées en utilisant des ondes de choc. Il a également été suggéré d'étendre cette idée à un système quaternaire, en incluant le silicium[8],[36].
Borures métalliques
Contrairement aux composés à base de carbone, les borures métalliques peuvent être synthétisés en grandes quantités à conditions ambiantes, ce qui est un avantage technologique important[9]. Quelques exemples sont RuB2, OsB2 et ReB2. La densité d'état électronique de ces matériaux révèle leur caractère métallique, mais la forte covalence des liaisons B-B et M-B (M est le métal) leur confère une grande dureté[37]. Les métaux comme l'osmium, le rhénium ou le tungstène sont préférés en raison de leur forte densité électronique, leur faible rayon atomique, leur module d'incompressibilité et leurs liaisons chimiques avec le bore fortement directionnelles. Les liaisons M-B contribuent à cela à cause du recouvrement entre les orbitales d des métaux de transitions et les orbitales p du bore[38].
Diborure d'osmium OsB2

Le diborure d'osmium OsB2 a un fort module d'incompressibilité de 395 GPa, et est de ce fait considéré comme un bon candidat, mais la dureté Vickers maximale obtenue est de 37 GPa, légèrement sous la limite de superdureté de 40 GPa. La manière habituelle de le synthétiser est par une réaction de métathèse à l'état solide avec un mélange de OsCl3:MgB2 dans une proportion 2:3[9]. Après élimination du MgCl2 produit, la diffraction des rayons X indique la présence de OsB2, OsB et Os. Chauffer ces produits à 1 000 °C pendant trois jours produit OsB2 pur sous forme cristalline. OsB2 a une structure cristalline orthorhombique (groupe d'espace Pmmn) avec deux plans formés d'atomes d'osmium séparés par une couche non plane d'atomes de bore de coordinence 6. Les paramètres de mailles sont a = 4,684 Å, b = 2,872 Å et c = 4,096 Å[9]. L'axe b et l'axe c sont les directions respectivement la plus compressible et la moins compressible[39]. Ceci peut s'expliquer par la structure orthorhombique. Si on regarde l'arrangement des atomes de bore et d'osmium dans les directions a et b, on constate qu'ils sont arrangés de telle manière qu'ils sont décalés entre eux, de sorte que quand on comprime le cristal dans ces directions, les atomes ne sont pas poussés directement les uns contre les autres. Or c'est la répulsion électrostatique qui maximise l'incompressibilité du composé, et elle n'est pas ici pleinement exploitée. En revanche, quand on comprime le cristal selon l'axe c, les atomes d'osmium et de bore sont pratiquement alignés et la répulsion électrostatique est forte, faisant de l'axe c la direction la moins compressible.
Ce modèle simple suggère que si les atomes de bore étaient répartis de manière plus régulière, l'incompressibilité pourrait être plus grande. La diffraction des électrons couplée aux mesures de dureté dans le plan (010) montrent que le cristal est 54 % plus dur dans la direction <100> que dans la direction <001>. Ceci peut être constaté en observant la forme de l'indentation selon les différentes directions. En plus de l'alignement des atomes, l'anisotropie est aussi due à la présence de liaisons B-B courtes (1,80 Å) dans la direction <001>, alors qu'elles sont absentes dans la direction <100> (B-B = 4,10 Å)[9].
Borures de rhénium
Le rhénium a été identifié comme un bon candidat pour les matériaux ultradurs en raison de ses propriétés physico-chimiques attractives. Il a une forte densité électronique, un petit rayon atomique et un fort module d'incompressibilité. Combiné avec le bore, il forme des cristaux fortement covalents, ce qui lui permet d'être très peu compressible et potentiellement très dur[40]. Une large palette de borures de rhénium a été explorée dont Re3B, Re7B3, Re2B, ReB, Re2B3, Re3B7, Re2B5, ReB3 et ReB2. Chaque composé a un ensemble de propriétés qui lui est propre mais, s'agissant de la superdureté, le plus pertinent est ReB2[40].
Le diborure de rhénium ReB2 est un composé réfractaire qui a été synthétisé pour la première fois dans les années 1960 en utilisant des fours à arc électrique ou la méthode de la zone fondue. Ce matériau peut être par exemple synthétisé par la méthode du flux, dans laquelle on place du rhénium métallique et du bore amorphe dans un creuset en alumine avec un excès d'aluminium. Ceci peut-être fait dans un rapport Re:B:Al de 1:2:50, en utilisant l'excès d'aluminium comme milieu de croissance. Le creuset est placé dans un tube d'alumine, inséré dans un four résistif sous flux d'argon et porté à 1 400 °C pendant plusieurs heures. Après refroidissement, l'aluminium est dissous dans la soude. Chaque méthode de synthèse a ses avantages et inconvénients propres, et celle-ci produit de petites inclusions d'aluminium incorporées au cristal[41].
Le diborure de rhénium a un point de fusion très élevé qui approche les 2 400 °C et une structure cristalline lamellaire très anisotrope[41]. Il peut adopter une structure soit hexagonale (groupe d'espace P63mc) ou orthorhombique (Cmcm) selon la phase. Dans ce cas, il y a alternance de couches d'atomes de rhénium compactes et de couches plissées d'atomes de bore formant des triangles dans le plan (001), dans une structure semblable à celle du diborure d'osmium. La densité d'état de ReB2 est une des plus faibles parmi les borures métalliques, ce qui indique des liaisons fortement covalentes et une bonne dureté[40].
Du fait de la nature très anisotrope de ce matériau, la dureté dépend de l'orientation cristalline. Le plan (002) présente le caractère le plus covalent et montre une dureté Vickers maximale de 40,5 GPa, tandis que celle dans les plans perpendiculaires sont de 6 % inférieures, à 38,1 GPa. Ces deux valeurs décroissent avec la charge utilisée pour le test et se stabilisent chacune à 28 GPa. Les valeurs obtenues en nanoindentation sont de 36,4 et 34,0 GPa respectivement pour les plans (002) et les plans perpendiculaires. La valeur de la dureté dépend de la pureté du matériau et de sa composition – plus la concentration de bore est élevée, plus le matériau est dur ; les valeurs données ci-dessus correspondent à un rapport Re:B d'environ 1:1.85. Le diborure de rhénium a également un module d'incompressibilité de 383 GPa et un module de cisaillement de 273 GPa[41],[42]. La dureté du diborure de rhénium et de la plupart des autres matériaux dépend également de la charge effective utilisée pour le test. Les valeurs rapportées au-dessus de 40 GPa ont été mesurées pour des charges de 0,5 à 1 N. Avec des charges aussi faibles, les duretés des autres matériaux sont également sous-estimées ; elle dépasse par exemple les 100 GPa pour c-BN[3]. D'autres chercheurs, tout en reproduisant la très haute dureté obtenue à faible charge, rapportent des valeurs beaucoup plus faibles, de l'ordre de 17-19 GPa, en utilisant des valeurs de charges plus conventionnelles de 3-49 GPa. Ceci fait de ReB2 un matériau dur, mais pas ultradur[3],[13],[43].
Le diborure de rhénium présente une conductivité métallique qui augmente quand la température diminue et peut s'expliquer par une densité d'état non nulle due au recouvrement des orbitales d et p du rhénium et du bore respectivement. À ce jour, c'est le seul matériau aussi dur et métallique. Il présente également une stabilité en température relativement bonne. En fonction de la méthode de chauffage, il peut maintenir sa masse jusqu'à des températures de 600-800 °C, avec quelques pertes de masse dues à la perte d'eau absorbée. Une faible perte de masse peut-être observée pour des températures approchant les 1 000 °C. L'effet est meilleur quand le chauffage est lent. Une partie de cette faible perte à 1 000 °C a été expliquée par la formation d'une fine couche de B2O3 à la surface à mesure que le bore est lessivé hors du solide, laquelle sert de couche de protection et réduit ensuite les pertes en bore. Elle peut être facilement dissoute dans le méthanol pour restaurer l'apparence brillante du composé initial[41],[42],[44].
Autres matériaux superdurs riches en bore
Parmi les autres matériaux durs à base de bore, on trouve le B4C et le B6O. Le B4C amorphe a une dureté d'environ 50 GPa, ce qui est dans la gamme des superdurs[45]. La structure peut être considérée comme des cristaux de bore icosaédrique plongés dans une matrice amorphe. Cependant, quand il est étudié sous sa forme cristalline, la dureté de B4C n'est que de 30 GPa. Cette forme cristalline a la même stœchiométrie que B13C3 qui consiste en des icosaèdres de bore reliés par des atomes de bore et de carbone.
L'oxyde de bore B6O a une dureté de 35 GPa environ. Sa structure contient huit icosaèdres B12, situés aux sommets d'une maille élémentaire rhomboédrique. Deux atomes d'oxygène sont sur la direction (111) du rhomboèdre[46].
Matériaux superdurs extrinsèques
Durcissement aux joints de grain : effet Hall-Petch
Une solution pour augmenter la dureté d'un matériau est de réduire le nombre de microfissures dans la structure grâce aux joints de grain. L'élimination des microfissures permet de multiplier la dureté par un facteur trois à sept. Ce durcissement par le joint de grain est décrit par la relation de Hall-Petch[47] :
- σc = σ0 + kgb/√d
Ici, σc désigne la contrainte critique de fracture, d est la taille des cristallites et σ0 et kgb sont des constantes.
Cependant, la dureté moyenne d'un matériau décroit quand la taille de grain passe en dessous de dix nanomètres. Des mécanismes microscopiques de glissement des joints de grain ont été proposés pour expliquer cette tendance, mais les détails du phénomènes ne sont pas encore compris.
Hétérostructures
Une autre voie explorée est celle des hétérostructures, ou nanostructures formées de deux matériaux de modules élastiques très différents. Ces hétérostructures ont été proposées en 1970 comme association de couches fines si ordonnées qu'elles ne peuvent être séparées par un moyen mécanique. On les prédisait plus dures qu'un simple mélange des deux matériaux. Cette théorie fut confirmée sur des structures Al/Cu et Al/Ag. Après ces premiers exemples, les études ont été étendues à des multicouches dont Cu/Ni, TiN/VN, Hf/HfN. Dans tous les cas, on constate qu'une réduction de la période de la structure augmente la dureté[8].
Les nanobaguettes de diamants agrégées constituent un exemple type de matériau ultradur nanostructuré. Il est plus dur que le diamant monocristallin (~150 GPa) et c'est actuellement le matériau le plus dur connu à ce jour[48].
Notes et références
- (en) Wentorf R. H., Devries R. C. et Bundy F. P., « Sintered Superhard Materials », Science, vol. 208, , p. 873–80 (DOI 10.1126/science.208.4446.873).
- (en) Anthony C. Fischer-Cripps, Nanoindentation, Springer, , 264 p. (ISBN 0-387-22045-3, lire en ligne), p. 198.
- (en) Dubrovinskaia N., Dubrovinsky L. et Solozhenko V. L., « Comment on Synthesis of Ultra-Incompressible Superhard Rhenium Diboride at Ambient Pressure », Science, vol. 318, , p. 1550c (DOI 10.1126/science.1147650).
- (en) S. Veprek (dir.), A. Zeer et R. Riedel, Handbook of Ceramic Hard Materials, Weinheim, Wiley, , 1020 p. (ISBN 3-527-29972-6).
- Maxime Lambert, « Le diamant n'est plus le matériau naturel le plus dur », Maxisciences, (consulté le ).
- John, P., « The oxidation of (100) textured diamond », Diamond and Related Materials, vol. 11, nos 3–6, , p. 861 (DOI 10.1016/S0925-9635(01)00673-2).
- Nassau, K., « The history and present status of synthetic diamond », Journal of Crystal Growth, vol. 46, no 2, , p. 157 (DOI 10.1016/0022-0248(79)90052-6).
- (en) Vepřek S., « The search for novel, superhard materials », Journal of Vacuum Science & Technology A: Vacuum, Surfaces, and Films, vol. 17, , p. 2401 (DOI 10.1116/1.581977).
- (en) Levine J. B., Tolbert S. H. et Kaner R. B., « Advancements in the Search for Superhard Ultra-Incompressible Metal Borides », Advanced Functional Materials, vol. 19, , p. 3519 (DOI 10.1002/adfm.200901257).
- (en) Haines J., Leger J. M. et Bocquillon G., « Synthesis and design of superhard materials », Annual Review of Materials Research, vol. 31, , p. 1 (DOI 10.1146/annurev.matsci.31.1.1).
- (en) V. Brazhkin, N. Dubrovinskaia, M. Nicol, N. Novikov, R. Riedel, V. Solozhenko et Y. Zhao, « From our readers: What does 'harder than diamond' mean? », Nature Materials, vol. 3, no 9, , p. 576-577 (DOI 10.1038/nmat1196).
- (en) V. L. Solozhenko et al., « Ultimate Metastable Solubility of Boron in Diamond: Synthesis of Superhard Diamondlike BC5 », Phys. Rev. Lett., vol. 102, , p. 015506 (DOI 10.1103/PhysRevLett.102.015506).
- (en) Jiaqian Qin, Duanwei He, Jianghua Wang, Leiming Fang, Li Lei, Yongjun Li, Juan Hu, Zili Kou et Yan Bi, « Is Rhenium Diboride a Superhard Material? », Advanced Materials, vol. 20, no 24, , p. 4780-4783 (DOI 10.1002/adma.200801471).
- (en) Lee, J. et Novikov N. V., Innovative superhard materials and sustainable coatings for advanced manufacturing, Boca Raton, Springer, , 512 p. (ISBN 0-8493-3512-4, lire en ligne), p. 102.
- Marinescu, I. D. ; Tönshoff, H. K. et Inasaki, I., Handbook of ceramic grinding and polishing, William Andrew, (ISBN 0-8155-1424-7, lire en ligne), p. 21.
- (en) Myer Kutz, Handbook of materials selection, New York, John Wiley & Sons, , 1497 p. (ISBN 0-471-35924-6, lire en ligne), p. 384.
- (en) Lanhua Wei, P. Kuo, R. Thomas, T. Anthony et W. Banholzer, « Thermal conductivity of isotopically modified single crystal diamond », Physical Review Letters, vol. 70, no 24, , p. 3764-3767 (DOI 10.1103/PhysRevLett.70.3764).
- (en) J Walker, « Optical absorption and luminescence in diamond », Reports on Progress in Physics, vol. 42, no 10, , p. 1605-1659 (DOI 10.1088/0034-4885/42/10/001).
- A. S. Barnard, The diamond formula: diamond synthesis—a gemmological perspective, Butterworth-Heinemann, 2000 (ISBN 0750642440).
- H. Liander, « Artificial diamonds » ASEA Journal, 28, 97 (1955).
- (en) « Man-Made Diamonds », Chemical & Engineering News, vol. 33, no 8, , p. 718 (DOI 10.1021/cen-v033n008.p718).
- (en) R. H. Wentorf, « Cubic Form of Boron Nitride », The Journal of Chemical Physics, vol. 26, no 4, , p. 956 (DOI 10.1063/1.1745964).
- (en) Kathleen Lonsdale, « Further Comments on Attempts by H. Moissan, J. B. Hannay and Sir Charles Parsons to Make Diamonds in the Laboratory », Nature, vol. 196, no 4850, , p. 104-106 (DOI 10.1038/196104a0).
- (en) Shane A. Catledge et Yogesh K. Vohra, « Effect of nitrogen addition on the microstructure and mechanical properties of diamond films grown using high-methane concentrations », Journal of Applied Physics, vol. 86, no 1, , p. 698 (DOI 10.1063/1.370787).
- (en) E. A. Ekimov, V. A. Sidorov, E. D. Bauer, N. N. Mel'nik, N. J. Curro, J. D. Thompson et S. M. Stishov, « Superconductivity in diamond », Nature, vol. 428, no 6982, , p. 542-545 (DOI 10.1038/nature02449).
- (en) G. Bocquillon, C. Loriers-Susse et J. Loriers, « Synthesis of cubic boron nitride using Mg and pure or M-doped Li3N, Ca3N2 and Mg3N2 with M=Al, B, Si, Ti », Journal of Materials Science, vol. 28, no 13, , p. 3547 (DOI 10.1007/BF01159836).
- Jochen Greim et Karl A. Schwetz, Boron Carbide, Boron Nitride, and Metal Borides, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a04_295.pub2).
- G. Leichtfried (dir.) et al., Landolt-Börnstein – Group VIII Advanced Materials and Technologies : Powder Metallurgy Data. Refractory, Hard and Intermetallic Materials, vol. 2A2, Berlin, Springer, , 267 p. (ISBN 978-3-540-42961-6, DOI 10.1007/b83029), chap. 13.5 (« Properties of diamond and cubic boron nitride »), p. 118–139.
- (en) M. A. El Khakani, « Physical properties of the x-ray membrane materials », Journal of Vacuum Science & Technology B: Microelectronics and Nanometer Structures, vol. 11, no 6, , p. 2930 (DOI 10.1116/1.586563).
- K.T. Wilke et J. Bohm, Kristallzüchtung, Verlag Harri Deutsch, Francfort, 1988.
- (en) A. Y. Liu et M. L. Cohen, « Prediction of New Low Compressibility Solids », Science, vol. 245, no 4920, , p. 841-842 (DOI 10.1126/science.245.4920.841).
- (en) D. M. Teter et R. J. Hemley, « Low-Compressibility Carbon Nitrides », Science, vol. 271, no 5245, , p. 53-55 (DOI 10.1126/science.271.5245.53).
- (en) Long-Wei Yin, Mu-Sen Li, Yu-Xian Liu, Jin-Ling Sui et Jing-Min Wang, « Synthesis of beta carbon nitride nanosized crystal through mechanochemical reaction », Journal of Physics: Condensed Matter, vol. 15, no 2, , p. 309-314 (DOI 10.1088/0953-8984/15/2/330).
- R. Badzian, T. Niemyski et E. Olkusnik, in Proceedings of the 3rd International Conference on Chemical Vapor Deposition, Salt Lake City, avril 1972, édité par F. A. Galski, p. 747.
- (en) Vladimir L. Solozhenko, Denis Andrault, Guillaume Fiquet, Mohamed Mezouar et David C. Rubie, « Synthesis of superhard cubic BC2N », Applied Physics Letters, vol. 78, no 10, , p. 1385 (DOI 10.1063/1.1337623).
- (en) Vladimir L. Solozhenko et Eugene Gregoryanz, « Synthesis of superhard materials », Materials Today, vol. 8, no 11, , p. 44-51 (DOI 10.1016/S1369-7021(05)71159-7).
- (en) Paul J. Robinson, Gaoxiang Liu, Sandra Ciborowski, Chalynette Martinez-Martinez, Juan R. Chamorro, Xinxing Zhang, Tyrel M. McQueen, Kit H. Bowen et Anastassia N. Alexandrova, « Mystery of Three Borides: Differential Metal–Boron Bonding Governing Superhard Structures », Chemistry of Materials, vol. 29, no 23, , p. 9892–9896 (DOI 10.1021/acs.chemmater.7b04378, lire en ligne).
- (en) Robert W. Cumberland, Michelle B. Weinberger, John J. Gilman, Simon M. Clark, Sarah H. Tolbert et Richard B. Kaner, « Osmium Diboride, An Ultra-Incompressible, Hard Material », Journal of the American Chemical Society, vol. 127, no 20, , p. 7264-7265 (DOI 10.1021/ja043806y).
- (en) Z. Chen, H. Xiang, Jinlong Yang, J. Hou et Qingshi Zhu, « Structural and electronic properties of OsB2: A hard metallic material », Physical Review B, vol. 74, no 1, (DOI 10.1103/PhysRevB.74.012102).
- (en) Huiyang Gou, Zhibin Wang, Jingwu Zhang, Shuting Yan et Faming Gao, « Structural Stability and Elastic and Electronic Properties of Rhenium Borides: First Principle Investigations », Inorganic Chemistry, vol. 48, no 2, , p. 581-587 (DOI 10.1021/ic8019606).
- (en) Jonathan B. Levine, Sandy L. Nguyen, Haider I. Rasool, Jeffrey A. Wright, Stuart E. Brown et Richard B. Kaner, « Preparation and Properties of Metallic, Superhard Rhenium Diboride Crystals », Journal of the American Chemical Society, vol. 130, no 50, , p. 16953-16958 (DOI 10.1021/ja804989q).
- (en) J.B. Levine, J.B. Betts, J.D. Garrett, S.Q. Guo, J.T. Eng, A. Migliori et R.B. Kaner, « Full elastic tensor of a crystal of the superhard compound ReB2 », Acta Materialia, vol. 58, no 5, , p. 1530-1535 (DOI 10.1016/j.actamat.2009.10.060).
- (en) Qinfen Gu, Guenter Krauss et Walter Steurer, « ChemInform Abstract: Transition Metal Borides: Superhard versus Ultra-Incompressible », ChemInform, vol. 39, no 50, (DOI 10.1002/chin.200850007).
- (en) Antonín Šimůnek, « Anisotropy of hardness from first principles: The cases of ReB2 and OsB2 », Physical Review B, vol. 80, no 6, (DOI 10.1103/PhysRevB.80.060103).
- (en) S. Ulrich, H. Ehrhardt, J. Schwan, R. Samlenski et R. Brenn, « Subplantation effect in magnetron sputtered superhard boron carbide thin films », Diamond and Related Materials, vol. 7, no 6, , p. 835-838 (DOI 10.1016/S0925-9635(97)00306-3).
- (en) Hervé Hubert, Laurence A. J. Garvie, Bertrand Devouard, Peter R. Buseck, William T. Petuskey et Paul F. McMillan, « High-Pressure, High-Temperature Synthesis and Characterization of Boron Suboxide (B6O) », Chemistry of Materials, vol. 10, no 6, , p. 1530-1537 (DOI 10.1021/cm970433+).
- Elisabeth Bouchaud, Dominique Jeulin et Claude Prioul, Physical aspects of fracture, Springer, 2001, p. 23 (ISBN 079237147X).
- (en) V. Blank, M. Popov, G. Pivovarov, N. Lvova, K. Gogolinsky et V. Reshetov, « Ultrahard and superhard phases of fullerite C60: Comparison with diamond on hardness and wear », Diamond and Related Materials, vol. 7, nos 2-5, , p. 427-431 (DOI 10.1016/S0925-9635(97)00232-X).
Articles connexes
- Portail de la physique
- Portail des sciences des matériaux