Méthacrylate de méthyle
Le méthacrylate de méthyle (MMA) est le monomère du polyméthacrylate de méthyle (Lucite, Plexiglas, Altuglas, Perspex). C’est un composé organique dont la formule semi-développée est CH2=C(CH3)CO2CH3.
| Méthacrylate de méthyle | |
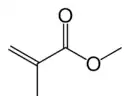  Structure du méthacrylate de méthyle |
|
| Identification | |
|---|---|
| Nom UICPA | 2-méthylprop-2-énoate de méthyle |
| No CAS | |
| No ECHA | 100.001.180 |
| No CE | 201-297-1 |
| FEMA | 4002 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
| Formule | C5H8O2 [Isomères] |
| Masse molaire[2] | 100,1158 ± 0,0052 g/mol C 59,98 %, H 8,05 %, O 31,96 %, |
| Moment dipolaire | 1,6-1,97 D |
| Propriétés physiques | |
| T° fusion | −48 °C[1] |
| T° ébullition | 100,5 °C[1] |
| Solubilité | dans l'eau à 20 °C : 16 g·l-1[1] |
| Masse volumique | 0,94 g·cm-3[1] |
| T° d'auto-inflammation | 421 °C[1] |
| Point d’éclair | 10 °C (coupelle ouverte)[1], 2 °C coupelle fermée |
| Limites d’explosivité dans l’air | 1,7–12,5 %vol[1] |
| Pression de vapeur saturante | 40 mbar à 20 °C 66,7 mbar à 30 °C 157 mbar à 50 °C |
| Viscosité dynamique | 0,6 cP à 20 °C |
| Thermochimie | |
| Cp | |
| Précautions | |
| SGH[4] | |
  Danger |
|
| SIMDUT[5] | |
  B2, D2B, |
|
| NFPA 704 | |
| Transport | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[6] | |
| Écotoxicologie | |
| LogP | 1,38[1] |
| DJA | 0,05 mg/kg p.c./jour[7] |
| Seuil de l’odorat | bas : 0,01 ppm haut : 0,46 ppm[8] |
| Unités du SI et CNTP, sauf indication contraire. | |
Cet ester méthylique de l’acide méthacrylique est un monomère qui se présente sous la forme d’un liquide incolore utilisé pour la fabrication de verres transparents et de plastiques en polyméthacrylate de méthyle (PMMA).
Production
Les principaux producteurs mondiaux sont Cyro, Arkema, BASF, Dow Chemical, Lucite, Celanese et Rohm and Haas, Mitsubishi Rayon et Sumitomo. Aux États-Unis en 1993, la production s'élevait à 600 000 tonnes par an (t/a) et la production mondiale a été estimée à 3,2 millions de t/a en 2005.[réf. nécessaire]
Pour sa fabrication, la plupart des fabricants utilisent la voie de la cyanohydrine d'acétone (ACH), pour laquelle l’acétone et le cyanure d'hydrogène servent de matières premières. La cyanohydrine qui est un produit intermédiaire est convertie par l'acide sulfurique en ester sulfaté du méthacrylamide, dont l'hydrolyse donne du bisulfate d’ammonium et de l’acide méthacrylique qui, estérifié avec du méthanol, donne le méthacrylate de méthyle. Certains producteurs asiatiques commencent avec l'isobutène, ou son équivalent, le tert-butanol, qui est oxydé en méthacroléine (acroléine méthylée), et de nouveau oxydé en acide méthacrylique ensuite estérifié par le méthanol pour former le méthacrylate de méthyle. Le propène peut être carbonylé en présence d'acides en acide isobutanoïque, qui subit ultérieurement une déshydrogénation[9].
La découverte d’une nouvelle technique de production du MMA utilisant comme catalyseur la phosphine et du palladium a été annoncée. Le processus Alpha de Lucite utilise l’éthylène, du monoxyde de carbone (CO) et du méthanol (CH3OH) comme matières premières pour produire du propanoate de méthyle, qui se combine ensuite avec le formaldéhyde (HCHO) pour produire du MMA et de l'eau[10].
Utilisations
La principale utilisation du méthacrylate de méthyle est la production de matière plastique acrylique en polyméthacrylate de méthyle. Le méthacrylate de méthyle est aussi utilisé pour la production du copolymères du méthacrylate de méthyle-butadiène-styrène (MBS), utilisé comme modificateur du polychlorure de vinyle (PVC).
Les polymères du méthacrylate de méthyle et les copolymères sont utilisés pour fabriquer des peintures à l'eau. Ils servent également à la formulation d’adhésifs.
Une application récente est l'utilisation de films pour empêcher la lumière des écrans LCD d'ordinateurs et de téléviseurs de diffuser de manière non directionnelle.
Le méthacrylate de méthyle est également utilisé pour préserver de la corrosion les moulages anatomiques d’organes, comme le cœur et les artères coronaires.
Il est également utilisé pour la formation d'ongles artificiels.
Ce composé organique est également présent dans certains médicaments, dans la liste des excipients. (par exemple dans la RITALINE L.P. 20mg)
Références
- METHACRYLATE DE METHYLE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 2, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-858-6)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Méthacrylate de méthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada
- « Methyl methacrylate », sur hazmap.nlm.nih.gov (consulté le )
- William Bauer, Jr. "Methacrylic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441. Article Online Posting Date: June 15, 2000
- http://www.chemsystems.com/reports/search/docs/abstracts/0405-2_abs.pdf
Liens externes
Liens en français
- Portail de la chimie

