Glaucome
Le glaucome est une maladie dégénérative du nerf optique qui entraîne une perte progressive de la vision commençant tout d'abord en périphérie et progressant graduellement vers le centre. Cette maladie est souvent associée à une pression intraoculaire (PIO) élevée qui comprime et endommage les fibres du nerf optique et de la rétine. Dans d'autres cas, malgré une PIO normale, une circulation sanguine inadéquate entraîne la mort (nécrose) des cellules du nerf optique et de la rétine. La perte de vision associée au glaucome est permanente et irréversible. Sans traitement, cette maladie peut mener à la cécité.
| Spécialité | Ophtalmologie |
|---|
| CISP-2 | F93 |
|---|---|
| CIM-10 | H40-H42 |
| CIM-9 | 365 |
| DiseasesDB | 5226 |
| MedlinePlus | 001620 |
| eMedicine | 1207470 |
| eMedicine | oph/578 |
| MeSH | D005901 |
| Médicament | Dipivefrine (en), carbachol (en), acétazolamide, diclofenamide (en), dorzolamide (en), diisopropylfluorophosphate, methazolamide (en), clonidine, mitomycine C, physostigmine, brinzolamide (en), chlorhydrate de clonidine (d), bimatoprost (en), tafluprost (en), pilocarpine, travoprost (en), brimonidine (en), dorzolamide / Timolol (d), latanoprost, ranibizumab (en), furtrethonium (d) et diisopropylfluorophosphate |
![]() Mise en garde médicale
Mise en garde médicale


Terminologie
Les types de glaucome sont nombreux avec des mécanismes différents. Le plus courant est le glaucome chronique à angle ouvert.
Le terme « glaucome » n'est pas utilisé pour les hypertonies oculaires (généralement modérées) sans retentissement sur le nerf optique qui sont tout de même à surveiller car un certain nombre peut évoluer en glaucome.
On sait aujourd'hui que le niveau d'hyperpression susceptible d'engendrer un glaucome est propre à chaque individu, ce qui rend le diagnostic de la maladie difficile à son début. La frontière est parfois difficile à établir entre hypertonie simple sans conséquence et hypertonie avec risque de glaucome. Il existe une relation et une continuité fréquente mais non systématique entre hypertonie oculaire et glaucome qui représentent en fait des stades différents d'une même maladie.
Les critères de diagnostic ont fort évolué ces dernières années. Toutes les personnes présentant une hyperpression oculaire ne développeront pas un glaucome et certaines personnes avec une pression considérée selon les anciens critères comme normale (à savoir entre 10 et 21 mmHg) seront atteintes par un glaucome.
Classification des glaucomes
Elles sont possibles selon différents critères. On est bien loin de la dichotomie classique : le glaucome chronique à angle ouvert (GPAO pour « primitif à angle ouvert » - dénomination internationale) et le glaucome aigu par fermeture de l’angle (GAFA), qui est une urgence ophtalmologique.
Un glaucome peut être classé selon l’angle irido-cornéen : à angle ouvert (chronique), par fermeture de l’angle (aigu) ou mixte.
Il peut être aigu (c’est le classique glaucome aigu par fermeture de l'angle), chronique ou subaigu.
Selon l’âge, on parle de glaucome congénital, c’est-à-dire présent dès la naissance et donc responsable d’une buphtalmie, de glaucome infantile qui apparaît entre 3-4 ans et 15 ans, de glaucome juvénile qui apparaît à partir de 10 ans et avant 40 ans, habituellement formes familiales, à évolution rapide, de glaucome chez l'adulte, forme la plus commune.
Les glaucomes par fermeture de l’angle (GAFA) sont classés en
- angle fermable : c'est-à-dire que moins de 1/4 (ou 90°) de trabéculum est visible en gonioscopie (en).
- fermeture de l’angle : c'est-à-dire angle fermable et pression intraoculaire (PIO) supérieure à 21 mmHg.
- glaucome chronique par fermeture de l’angle : c'est-à-dire angle fermable et pression intraoculaire (PIO) supérieure à 21 mmHg avec en plus un champ visuel (CV) abîmé.
Il peut exister des formes associées :
- endothéliale : ce sont les ICE syndrome, la dystrophie de Fuchs, le glaucome néovasculaire, le syndrome de Peter.
- iris : ce sont l’iridoschisis et l’aniridie.
- rétine : c’est le cas du glaucome dû à un décollement de rétine. C’est l’origine du glaucome néovasculaire dont le primum movens est l’ischémie rétinienne.
- tumeur : c’est le glaucome mélanocytaire.
- les maladies générales : ce sont le Sturge-Weber, la fistule carotido-caverneuse, le glaucome secondaire à la prise de corticoïdes.
Causes
Il existe une prédisposition génétique qui peut expliquer certains glaucomes[1]. La mutation de plusieurs gènes peut provoquer un glaucome, dont le MYOC (codant la myocilline) et l'OPT (codant l'optineurine)[2]. D'autres ne font qu'augmenter le risque, comme ceux concernant les gènes CAV1 et CAV2[3], le gène CDKN2BAS[4].
Selon la cause, les glaucomes sont classés en « primitif », c'est-à-dire sans cause connue, ou en « secondaire », dont le glaucome pigmentaire, le glaucome exfoliatif, le glaucome néovasculaire, le glaucome traumatique, le glaucome du pseudophaque.
Des glaucomes post-opératoires surviennent aussi parfois après une chirurgie cornéenne ou rétino-vitréenne. Leurs mécanismes peuvent être un bloc pupillaire (glaucome malin), par invasion épithéliale ou endothéliale.
Des « troubles de la vision avec constriction du champ visuel » sont depuis longtemps connus chez les intoxiqués au mercure en contexte industriel ou d'orpaillage (dont en Guyane[5] et en Amazonie brésilienne[6] par exemple). L'intoxication mercurielle aiguë conduit à « des déficits visuels au niveau de la vision des couleurs, une constriction du champ visuel et à une perte de sensibilité aux contrastes aux fréquences spatiales intermédiaires et élevées »[7],[8],[6], avec une relation dose-dépendante semble-t-il (les symptômes sont plus marqués chez les patients présentant les taux de mercure les plus élevés dans les cheveux[6]). Cet effet pourrait ne pas être uniquement de type neurotoxique ou neuromusculaire, car il a aussi été récemment (2015) montré que le risque de glaucome augmente statistiquement chez les personnes ayant un taux sanguin de mercure plus élevé que la moyenne et/ou un déficit en manganèse alors qu'aucune association n'a été découverte pour le plomb et le cadmium sanguin ou l'arsenic dans les urines (selon une étude basée sur 2 600 Coréens de 19 ans et plus)[9].
Une prise à long terme d'amines sympathomimétiques (éphédrine, pseudoéphédrine, méthylphénidate) ou de substances stimulantes agissant sur le système sympathique (amphétamines, cathinones) augmente la pression intraoculaire et favorise un risque de déclenchement de crise de glaucome.
Classification
Selon le mécanisme causal ou actif, on parle de :
- glaucome à angle ouvert avec :
- obstacle prétrabéculaire : ICE syndrome, et glaucome néo vasculaire ;
- obstacle trabéculaire : GPAO, corticoïdes, glaucome juvénile ;
- obstacle post-trabéculaire : par hyperpression veineuse (fistule carotido-caverneuse, Sturge-Weber) ;
- glaucome à angle fermé :
- par bloc pupillaire antérieur : il est exceptionnel
- par bloc pupillaire postérieur
- sans bloc pupillaire : c’est l’iris plateau.
- anomalie angulaire : c’est le glaucome congénital.
Anatomie et physiologie
Humeur aqueuse

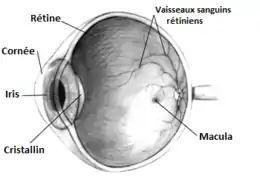
La pression intraoculaire est fonction du volume d'humeur aqueuse contenue dans la chambre antérieure de l'œil. Cette humeur aqueuse est sécrétée par le corps ciliaire dans l'espace appelé chambre postérieure, puis passe à travers la pupille (entre l'iris et le cristallin) dans la chambre antérieure (espace entre la cornée et le rideau irien). Elle est ensuite résorbée dans l'angle irido-cornéen au travers du filtre trabéculaire trabéculum, puis drainée dans le canal de Schlemm. Elle se jette enfin dans les veines sclérales pour rejoindre la circulation veineuse générale.
Pression intraoculaire
La pression intraoculaire habituelle chez l'adulte est comprise entre 10 et 21 mmHg (moyenne de 16). Elle est mesurée à l'aide de tonomètres automatisés à jet d'air.
Définir la PIO normale chez une personne donnée nécessite de connaître la rigidité de la cornée qui dépend essentiellement de son épaisseur. En effet, la mesure ne se fait pas directement dans l'humeur aqueuse mais à travers la cornée. Aussi, cette dernière influence la mesure.
Les personnes ayant une cornée épaisse ont une pression oculaire mesurée plus élevée que les personnes dotées d'une cornée fine. Par ailleurs, la pression oculaire augmente naturellement avec l'âge.
Autrement dit, la mesure de la pression oculaire n'est qu'un paramètre qui demande à être interprété en fonction de l'épaisseur cornéenne et de l'âge de la personne. Ce critère donné isolément ne permet donc pas d'affirmer qu'une personne est porteuse d'une maladie glaucomateuse ni qu'elle en est indemne.
Mécanisme des glaucomes
Hypertonie oculaire
L'hypertonie oculaire n'est qu'un symptôme comme l'est la fièvre par exemple. La pression oculaire peut être retrouvée élevée dans de nombreuses affections oculaires différentes qui vont définir autant de types particuliers d'hypertonie oculaire ou de glaucomes.
Les mécanismes les plus courants sont :
- une diminution de l'élimination par obstruction de l'angle irido-cornéen d'origine congénitale par une membrane résiduelle embryonnaire (membrane de Barkan) glaucome congénital ou acquise avec l'âge par sclérose du trabéculum. Ce second cas correspond au glaucome chronique à angle ouvert (angle dit ouvert car normal anatomiquement). Il s'agit de la cause d'hypertonie oculaire de loin la plus fréquente en pratique ;
- un blocage pupillaire par le cristallin secondaire au vieillissement. Celui-ci augmente de volume et peut provoquer un blocage de l'orifice pupillaire. L'humeur aqueuse s'accumule alors derrière l'iris et pousse celui-ci en avant, ce qui entraîne chez certaines personnes prédisposées (personnes dont l'angle iridocornéen est déjà étroit, cas que l'on rencontre surtout chez des hypermétropes) une fermeture complète de l'angle. C'est le mécanisme des crises de glaucome aigu dit par fermeture de l'angle. Plus rarement le blocage pupillaire se fait par synéchies irido-cristalliniennes compliquant une uvéite antérieure aigüe non traitée. Le cristallin colle sur le rebord irien et empêche le passage de l'humeur aqueuse ;
- par augmentation de sécrétion ciliaire. Elle est classique dans les uvéites antérieures aigües (on parle ici d'uvéite hypertensive plutôt que de glaucome). Il s'agit d'une cause rare.
Conséquences
Les conséquences d'une hyperpression intraoculaire se font essentiellement au niveau des fibres optiques dans leur passage à travers la lamina cribosa (en)[10], structure visible au fond d’œil sous le nom de papille optique par laquelle les fibres nerveuses se rassemblent et sortent du globe oculaire pour constituer le nerf optique. L'hypertonie oculaire va provoquer un blocage du transport axonal[11] entraînant une dégénérescence de ces fibres. Cette hypertonie aura des conséquences d'autant plus rapides qu'elle est élevée et prolongée.
Son retentissement, surtout si elle est chronique, dépendra aussi de la qualité de la microcirculation du sujet : ce sont les « facteurs vasculaires du glaucome chronique à angle ouvert ». Ainsi, les facteurs de risque vasculaire, d'artériosclérose (hypertension artérielle, diabète sucré, tabagisme, hypercholestérolémie) seront à corriger eux aussi quand on traite un glaucome chronique.
En pratique, l'hyperpression oculaire est responsable d'une neuropathie optique dégénérative. Un nerf optique normal contient plus d'un million de fibres à la naissance. Naturellement, le nombre de fibres diminue au fil du temps à raison d'environ 5 000 fibres par an. L'hyperpression oculaire va entraîner une accélération de cette dégénérescence.
Une autre conséquence de l'hyperpression oculaire, si elle est majeure (supérieure à 40 ou 50 mmHg, telle qu'on l'observe dans les glaucomes aigus), est une sidération de l'activité ou une destruction des cellules endothéliales cornéennes qui entraîne l'apparition d'un œdème cornéen décrit comme une « buée épithéliale ».
L'explication des glaucomes avec pression intraoculaire normale serait une baisse de la pression du liquide cérébrospinal autour du nerf optique, avec pour conséquence, une augmentation du gradient de pression entre l'intérieur de l’œil et l'extérieur[12].
Toute maladie préexistante du système nerveux optique pourrait fragiliser ce dernier à une augmentation de la pression intraoculaire[11].
Diagnostic
La tonométrie permet de mesurer la pression intraoculaire de manière indirecte. Les premières techniques consistaient à détecter une déformation du globe oculaire suivant la pression exercée par un capteur (tonométrie à aplanation). La technique actuelle applique cette force sans contact grâce à un flux d'air.
Le fond d'œil permet de visualiser les déformations de la papille optique et rechercher des causes au glaucome ou des atteintes associées. Les anomalies ne sont parfois pas évidentes avec des désaccords de jugement entre spécialistes[13]. La précision du diagnostic peut être aidée par d'autres techniques, tomographie à cohérence optique ou polarimétrie à balayage laser[14].
La mesure du champ visuel permet d'estimer les conséquences du glaucome mais un déficit signe souvent une atteinte déjà évoluée[11].
Prévention
Une étude parue dans le British Journal of Ophtalmology rapporte que la consommation quotidienne de thé chaud rend le diagnostic de glaucome moins probable[15].
Traitement
Il s'agit principalement de traiter l'hypertonie oculaire, ce qui permet de réduire l'évolutivité sur l'atteinte visuelle[16]. Le but est de réduire cette pression intraoculaire d'environ 20 à 50 %[11]. La place des différents traitements disponibles (médical, laser, chirurgie) n'est cependant pas claire, du moins dans le cas du glaucome à angle ouvert, où leur efficacité est comparable[17].
Traitement médical
Il s'agit souvent d'un traitement prescrit à vie, qui agit sur deux mécanismes : la diminution de la sécrétion d'humeur aqueuse ou l'augmentation de l'élimination d'humeur aqueuse. Ils sont, dans presque la totalité des cas, sous forme de collyres.
- diminution de la sécrétion d'humeur aqueuse
- collyres bêta-bloquants : lévobunolol, timolol
- inhibiteurs de l'anhydrase carbonique (par collyre ou voie générale) : dorzolamide, brinzolamide
- collyre agoniste alpha-2 adrénergiques : brimonidine
- augmentation de l'élimination d'humeur aqueuse
- dérivés adrénaliniques
- collyres myotiques parasympathiques : pilocarpine
- analogues des prostaglandines : latanoprost, travoprost, bimatoprost
Ces médicaments sont à peu près équivalents en termes d'efficacité[18]. En absence de contre-indication, on prescrira en première intention un collyre bêta-bloquant. En seconde intention ou s'il existe des contre-indications aux bêta-bloquants, on prescrira d'autres collyres hypotonisants. Il est fréquent d'associer plusieurs classes thérapeutiques.
Traitement au laser
On réalise une trabéculoplastie sélective (souvent abrégé en SLT qui vient de l'anglais selective laser trabeculoplasty). Grâce à un laser, on photocoagule l'angle irido-cornéen, ainsi l'humeur aqueuse est éliminée plus rapidement. Cette technique permet d'améliorer la pression intra-oculaire dans près de 80 % des cas, avec cependant une diminution de l'efficacité avec le temps et un risque d'échec plus important dans les cas évolués[19].
Traitement chirurgical
On réalise une trabéculectomie, au niveau de la conjonctive, on fait une fenêtre (que l'on referme après l'opération) par laquelle on réalise un petit « trou » permettant à l'humeur aqueuse de circuler de part et d'autre de l'iris. Une technique alternative consiste à placer un minitube dans cette ouverture, avec un taux de réussite un peu supérieur à la trabulectomie seule[20].
Traitement par ultrasons
Réalisant une nécrose partielle des corps ciliaires visant à réduire la production d'humeur aqueuse, le traitement du glaucome par ultrasons focalisés de haute intensité a été expérimenté pour la première fois par une équipe lyonnaise en 2010[21]. Permettant de réaliser une cyclo coagulation circulaire par ultrasons (UC3) il a démontré une efficacité au moins comparable à celle du laser diode et une tolérance significativement améliorée[22]. L'ablation thermique réalisée au moyen des ultrasons focalisés de haute intensité (HIFU) sur les corps ciliaires semble être précise et très sélective, ce qui se traduit par une très bonne tolérance, peu d'inflammation et aucun impact sur les tissus environnants[23].
Surveillance
Elle doit être régulière (tous les 6 mois à 1 an), sont évalués :
- la pression intra-oculaire
- la tête du nerf optique
- le champ visuel
Notes et références
- (en) Thorleifsson G, Magnusson KP, Sulem P, Walters GB, Gudbjartsson DF, Stefansson H, Jonsson T, Jonasdottir A, Jonasdottir A, Stefansdottir G, Masson G, Hardarson GA, Petursson H, Arnarsson A, Motallebipour M, Wallerman O, Wadelius C, Gulcher JR, Thorsteinsdottir U, Kong A, Jonasson F, Stefansson K. « Common sequence variants in the LOXL1 gene confer susceptibility to exfoliation glaucoma » Science 2007;317(5843):1397-400.
- (en) Rezaie T, Child A, Hitchings R et al. Adult-onset primary open-angle glaucoma caused by mutations in optineurin, Science, 2002;295:1077-1079
- (en) Thorleifsson G, Walters GB, Hewitt AW et al. Common variants near CAV1 and CAV2 are associated with primary open-angle glaucoma, Nat Genet, 2010;42:906-909
- (en) Wiggs JL, Yaspan BL, Hauser MA et al. Common variants at 9p21 and 8q22 are associated with increased susceptibility to optic nerve degeneration in glaucoma, PLoS Genet, 2012;8:e1002654
- Boudou A, Dominique Y, Cordie, S & Frery N (2006) Les chercheurs d’or et la pollution par le mercure en Guyane française : conséquences environnementales et sanitaires. Environnement, Risques & Santé, 5(3), 167-179.
- Fillion, M. (2011). Risques et bénéfices de l'alimentation locale des communautés riveraines en Amazonie brésilienne: les effets du mercure, du plomb, du sélénium et des acides gras oméga-3 sur des fonctions visuelles.
- (en) Lebel, J., D. Mergler, F. Branches, M. Lucotte, M. Amorim, F. Larribe et J. Dolbec. 1998. «Neurotoxic effects of low-Ievel methylmercury contamination in the Amazonian Basin». Environ Res. vol. 79, no l, p. 20-32. En ligne
- (en) Lebel, J., D. Mergler, M. Lucotte, M. Amorim, J. Dolbec, D. Miranda, G. Arantes, 1. Rheault et P. Pichet. 1996. «Evidence of early nervous system dysfunction in Amazonian populations exposed to low-levels of methylmercury». Neurotoxicology. vol. 17, no 1, p. 157-167. En ligne.
- (en) Lin S.C, Singh K & Lin S.C. (2015). Association Between Body Levels of Trace Metals and Glaucoma Prevalence. JAMA ophthalmology.(résumé)
- Quigley HA, Addicks EM, Green WR, Maumenee AE, Optic nerve damage in human glaucoma, II: the site of injury and susceptibility to damage, Arch Ophthalmol, 1981;99:635-649.
- Weinreb RN, Aung T, Medeiros FA, The pathophysiology and treatment of glaucoma: A review, JAMA, 2014;311:1901-1911.
- Wang N, Xie X, Yang D et al. Orbital cerebrospinal fluid space in glaucoma: the Beijing Intracranial and Intraocular Pressure (iCOP) study, Ophthalmology, 2012;119:2065e1-2073e1.
- (en) Jampel HD, Friedman D, Quigley H et al. Agreement among glaucoma specialists in assessing progressive disc changes from photographs in open-angle glaucoma patients, Am J Ophthalmol, 2009;147:39e1-44 e1
- (en) Medeiros FA, Zangwill LM, Bowd C, Weinreb RN, Comparison of the GDx VCC scanning laser polarimeter, HRT II confocal scanning laser ophthalmoscope, and stratus OCT optical coherence tomograph for the detection of glaucoma, Arch Ophthalmol, 2004;122:827-837
- (en) Connie M. Wu, Annie M. Wu, Victoria L. Tseng, Fei Yu et Anne L. Coleman, « Frequency of a diagnosis of glaucoma in individuals who consume coffee, tea and/or soft drinks », British Journal of Ophthalmology, (lire en ligne)
- Heijl A, Leske MC, Bengtsson B, Hyman L et al. Reduction of intraocular pressure and glaucoma progression, Arch Ophthalmol, 2002;120:1268-1279
- Boland MV, Ervin AM, Friedman DS et al. Comparative effectiveness of treatments for open-angle glaucoma: a systematic review for the US Preventive Services Task Force, Ann Intern Med, 2013;158:271-279
- Stewart WC, Konstas AG, Nelson LA, Kruft B, Meta-analysis of 24-hour intraocular pressure studies evaluating the efficacy of glaucoma medicines, Ophthalmology, 2008;115:1117e1-1122e1
- Odberg T, Sandvik L, The medium and long-term efficacy of primary argon laser trabeculoplasty in avoiding topical medication in open angle glaucoma, Acta Ophthalmol Scand, 1999;77:176-181
- Gedde SJ, Schiffman JC, Feuer WJ et al. Treatment outcomes in the Tube Versus Trabeculectomy (TVT) study after five years of follow-up, Am J Ophthalmol, 2012;153:789e2-803e2.
- Aptel F, Denis P. « Glaucomes : un nouveau traitement chirurgical par cyclo coagulation aux ultrasons » e-Mem Acad Chir. 2012;11(4):77-83.
- (en) Aptel F, Charrel T, Lafon C, Romano F, Chapelon JY, Blumen-Ohana E, Nordmann JP, Denis P. « Miniaturized high-intensity focused ultrasound device in patients with glaucoma: a clinical pilot study » Invest Ophthalmol Vis Sci. 2011;52(12):8747-53.
- « Société Française du Glaucome - Traitement UC3 »
Voir aussi
Articles connexes
- Alfred Vogt, inventeur de la cyclodiathermie dans le traitement du glaucome (opération de Vogt)
- Fondation BrightFocus
Différents types de glaucome :
- Glaucome chronique à angle ouvert (GCAO) : c'est de loin le plus fréquent et quand on dit d'une personne qu'elle est atteinte d'un glaucome sans plus de précision, c'est souvent de ce type de glaucome qu'il s'agit
- Glaucome aigu à angle fermé (GAAF)
- Glaucomes secondaires
- Glaucome néovasculaire
- Glaucome congénital
Liens externes
- Ressources relatives à la santé :
- ICD-10 Version:2016
- ICD9Data.com
- NCI Thesaurus
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Glaucome.net Public et professionnel, informations et revue de presse
- Société Française du Glaucome SFG
- La fondation du glaucome du Québec
- Informations sur le Glaucome par l'Union Nationale des Aveugles et Déficients Visuels
- Portail de la médecine
- Portail de l’œil et de la vue