Géométrie moléculaire coudée
En chimie, une géométrie moléculaire coudée est la géométrie des molécules où un atome au centre est lié à deux atomes ou ligands, et peut posséder un à deux doublets non liants autour de l’atome central. Cette géométrie s'appelle aussi parfois angulaire ou sous forme de V.
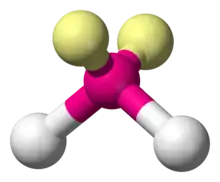
Certain atomes, tels que l'oxygène, ont presque toujours leurs deux (ou plus) liaisons covalentes dans des directions non colinéaires à leur configuration électronique. L'eau (H2O) est un exemple de molécule coudée, tout comme ses analogues. Dans ce cas, l'angle de liaison entre les deux atomes d'hydrogène est d'environ 104,45°[1]. Cette géométrie non linéaire est commune à d'autres molécules et ions triatomiques ne contenant que des éléments du groupe principal ; on peut notamment citer le dioxyde d'azote (NO2), le dichlorure de soufre (SCl2) et le méthylène (CH2).
Variantes
Cette géométrie est presque toujours en accord avec la théorie VSEPR qui explique la non-colinéarité des atomes par la présence d'un ou plusieurs doublets non liants. Il existe plusieurs variantes de géométrie coudée. Elles sont formées d'un atome central, noté A, lié à deux ligands, notés X, avec de zéro à deux doublets non liants, notés E, sur l'atome central ; ces configurations sont notées respectivement AX2, AX2E1 et AX2E2.
La variante la plus commune étant la AX2E2 où deux liaisons covalentes et deux doublets non liants forment une couche complète de huit électrons autour de l'atome central. L'angle de liaison varie de 104° à 109,5°, cette dernière valeur correspondant à ce que prédit la théorie dans le cas d'une symétrie tétraédrique de quatre orbitales sp3 hybridées. Les angles les plus communs sont 105°, 107° et 109° ; ces variations s'expliquent du fait des propriétés des différents ligands.
Les molécules de type AX2E1, tels que SnCl2, possèdent trois orbitales sp2 et n'ont qu'un seul doublet non liant ; elles optent pour cette géométrie, avec un angle central d'environ 120°.
Il existe des composés de métaux de transition avec des orbitales hybride sd sans doublet non liant (AX2). Leur angle central est d'environ 90°, et leur géométrie est caractérisée de coudée également. C'est par exemple le cas de l'ion pervanadyle, VO2+.
 | 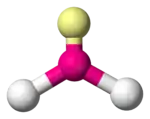 |  | |
| Notation VSEPR | AX2E0 (AX2) | AX2E1 | AX2E2 |
| Exemple | VO2+ | SO2 | H2O |
| Symétrie moléculaire | C2v | C2v | |
| Nombre stérique | 3 | 3 | 4 |
| Coordinence | 2 | 2 | 2 |
| Doublets non liants | 0 | 1 | 2 |
| Angle | 120° | > 104-109,5° |
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bent molecular geometry » (voir la liste des auteurs).
- (en) G. L. Miessler et D. A. Tarr, Inorganic Chemistry, Pearson/Prentice Hall (ISBN 0-13-035471-6)
- Portail de la chimie