Exon
Dans les gènes des organismes eucaryotes, les exons sont les segments d’un précurseur ARN qui sont conservés dans l’ARN après épissage et que l'on retrouve dans l'ARN mature dans le cytoplasme. Les segments du précurseur ARN qui sont éliminés lors de l'épissage s'appellent par opposition des introns[1]. On trouve principalement les exons dans les ARN messagers (ARNm) codant des protéines. Certains ARNm peuvent parfois subir un processus d'épissage alternatif, dans lequel un ou plusieurs exons peuvent être excisés ou certains introns conservés dans de rares cas[2].
De manière générale, les gènes sont constitués d'une suite d'exons et d'introns alternés, débutant et se finissant par un exon. Par exemple :
Exon 1 - Intron 1 - Exon 2 - Intron 2 - Exon 3 - … - Intron n-1 - Exon n
Après la transcription dans le noyau (chez les eucaryotes), l'ARN synthétisé va subir un certain nombre de modifications, dont l'épissage, au cours duquel les exons vont être suturés et les introns excisés de l'ARN, afin de donner l'ARN mature fonctionnel, comme l'ARNm utilisé pour la traduction en protéine après export dans le cytoplasme.
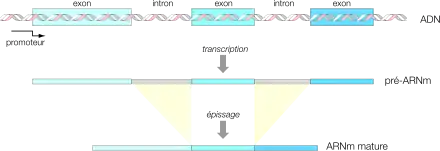
Dans leur grande majorité, les gènes des eucaryotes supérieurs contiennent des introns ; toutefois, certains ne sont composés que d'un seul exon, c'est par exemple de cas des gènes des histones chez les chordés. Environ 3 % seulement des gènes humains ne contiennent qu'un seul exon et donc aucun intron[3].
Il existe aussi de manière plus rare des introns dans certains gènes bactériens ou d'archées[4], ainsi que dans certains virus qui les infectent. Il s'agit souvent d'introns d'un type particulier appelés introns autoépissables.
Exons et régions codantes
Il est important d’éviter une confusion entre les notions d’exon/intron de celles de codant/non codant. Les exons ne peuvent en aucun cas être définis comme les parties codantes des transcrits.
- Pour les gènes qui codent des protéines, l’ARN messager comporte des régions non traduites en amont (5’UTR) et en aval (3’UTR) de la séquence codante. Les UTR sont présents dans l'ARN mature après épissage et sont donc exoniques, mais sont par définition non codants, puisque les séquences correspondantes sont situées en amont du codon de démarrage de la traduction ou en aval du codon stop terminant le cadre de lecture ouvert.
- Plusieurs types d'ARN sont non codants (ARN de transfert, ARN ribosomique, longs ARN non codants…), ce qui ne les empêche pas d'être épissés (et donc de comporter des introns et exons).
- Du fait de l’épissage alternatif, certaines régions de l’ARN peuvent être soit exoniques soit introniques selon le tissu ou les conditions cellulaires. Ces fragments sont potentiellement codants (ils peuvent servir de modèle à la synthèse du polypeptide), mais introniques dans certains tissus.
Distribution des exons
La taille des exons dans les génomes suit une distribution log-normale, avec une longueur moyenne d'environ 150 nucléotides[5] qui varie relativement peu entre les différentes espèces d'eucaryotes. Le caractère log-normal de cette distribution implique cependant une assez grande variabilité autour de cette valeur moyenne. Le plus grand exon connu est ainsi long de 17 106 nucléotides, il est situé dans le gène humain codant la protéine géante titine. C'est aussi le gène comportant le plus grand nombre d'exons, pas moins de 363 en tout[6].
Dans le génome humain, les gènes contiennent en moyenne environ 9 exons et 8 introns[7]. Toutefois, il existe également une variabilité importante, par exemple certains gènes humain ne contiennent qu'un seul exon et aucun d'intron. C'est le cas des gènes codant les histones.
Notes et références
- Donald Voet et Judith G. Voet, Biochimie, Paris, de Boeck, , 1600 p. (ISBN 978-2-8041-4795-2), section 31-4
- « Étude de la régulation de l'épissage alternatif »
- Ewa A. Grzybowska, « Human intronless genes: functional groups, associated diseases, evolution, and mRNA processing in absence of splicing », Biochemical and Biophysical Research Communications, vol. 424, no 1, , p. 1–6 (ISSN 1090-2104, PMID 22732409, DOI 10.1016/j.bbrc.2012.06.092, lire en ligne, consulté le )
- F. Martínez-Abarca et N. Toro, « Group II introns in the bacterial world », Molecular Microbiology, vol. 38, no 5, , p. 917–926 (ISSN 0950-382X, PMID 11123668, lire en ligne, consulté le )
- M. Long, C. Rosenberg et W. Gilbert, « Intron phase correlations and the evolution of the intron/exon structure of genes », Proceedings of the National Academy of Sciences of the United States of America, vol. 92, no 26, , p. 12495–12499 (ISSN 0027-8424, PMID 8618928, PMCID 40384, lire en ligne, consulté le )
- M. L. Bang, T. Centner, F. Fornoff et A. J. Geach, « The complete gene sequence of titin, expression of an unusual approximately 700-kDa titin isoform, and its interaction with obscurin identify a novel Z-line to I-band linking system », Circulation Research, vol. 89, no 11, , p. 1065–1072 (ISSN 1524-4571, PMID 11717165, lire en ligne, consulté le )
- Liucun Zhu, Ying Zhang, Wen Zhang et Sihai Yang, « Patterns of exon-intron architecture variation of genes in eukaryotic genomes », BMC Genomics, vol. 10, , p. 47 (ISSN 1471-2164, PMID 19166620, PMCID 2636830, DOI 10.1186/1471-2164-10-47, lire en ligne, consulté le )
Voir aussi
Articles connexes
Liens externes
- Dotplot, application en ligne permettant de mettre en évidence introns et exons.
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire