Diagramme de Frost
Le diagramme de Frost permet de prévoir rapidement la stabilité des différentes formes redox d'un élément chimique (par exemple si l'élément chimique considéré est l'oxygène : O2, H2O2 et H2O) à un pH donné.
Un diagramme de Frost est un graphe plan dont l'abscisse est un axe de degrés d'oxydation n (sans unité) et l'ordonnée est un axe gradué en volts. Chaque point représentatif de l'élément chimique considéré au nombre d'oxydation n a pour abscisse n et pour ordonnée le produit n·E°(A(n)/A(0)), produit du degré d'oxydation n par le potentiel de référence E° entre l'élément chimique A au nombre d'oxydationn' et le corps simple correspondant A au nombre d'oxydation 0.
Dans le cas du fer considéré aux nombres d'oxydation 0, II et III, le fer métallique Fe est représenté par l'origine du graphe, l'ion Fe2+ est représenté par un point d'abscisse 2 et d'ordonnée 2E°(Fe2+/Fe) et l'ion Fe3+ est représenté par un point d'abscisse 3 et d'ordonnée 3E°(Fe3+/Fe).
Un diagramme de Frost a donc autant de points que ce que l'élément chimique considéré a de degrés d'oxydation. Par exemple, le diagramme de Frost de l'élément chimique chlore a six points qui représentent respectivement Cl−, Cl2, HClO, ClO2−, ClO3− et ClO4−.
Approche thermodynamique
La variation de l'enthalpie libre ΔG° d'une demi-équation d'oxydoréduction dont le potentiel redox standard (sens oxydant → réducteur) est égale à E° et pour laquelle le nombre d'électrons échangé vaut n, est égale à :
- ΔrG° = −nFE°
où F est la constante de Faraday qui vaut 96 500 C (la charge d'une mole d'électrons).
Soit, pour la demi-équation entre un élément aux degrés d'oxydation i et j (avec i − j = n)
- ΔrG°(i→j) = −nFE°(i/j)
Si l'on considère la réaction qui permet de passer d'un degré d'oxydation quelconque au degré zéro d'un élément donné, l'enthalpie libre (qui est une fonction d'état) de la réaction s'écrit à l'aide des enthalpies libres de formation des composés considérés loi de Hess :
- ΔrG°(i→0) = ΔfG°(0) − ΔfG°(i)
Or
- ΔfG°(0) = 0
Donc
- ΔrG°(i→0) = −ΔfG°(i) = −nFE°(i/0)
Ou
- ΔfG°(i)/F = nE°(i/0)
À une constante près, l'ordonnée du diagramme de Frost représente donc l'enthalpie libre de formation de l'espèce de degré d'oxydation i.
La valeur de l'enthalpie libre ne variant pas selon le chemin réactionnel suivi, cela permet de déterminer la variation de l'enthalpie libre entre deux degrés d'oxydation quelconques, et par là même le potentiel redox associé. L'application du deuxième principe de la thermodynamique permet également de déterminer rapidement la stabilité thermodynamique de tel ou tel degré d'oxydation en étudiant la variation d'enthalpie libre des réactions de dismutation ou de médiamutation qui y mènent.
Exemple du diagramme de Frost du chlore
Le chlore possède six principaux degrés d'oxydation correspondant aux espèces suivantes à pH = 0 :
- −1 : Cl− : ion chlorure
- 0 : Cl2 : dichlore
- +1 : HClO : acide hypochloreux
- +3 : HClO2 : acide chloreux
- +5 : ClO3− : ion chlorate
- +7 : ClO4− : ion perchlorate
Les potentiels rédox par de chaque couple X/dichlore (ou inversement s'il s'agit de l'ion chlorure) sont les suivants :
- Couples redox / Potentiels redox standard (V)
- Cl2/Cl− : 1,36
- HClO/Cl2 : 1,63
- HClO2/Cl2 : 1,66
- ClO3−/Cl2 : 1,47
- ClO4−/Cl2 : 1,39
Les produits n·E° du nombre d'oxydation par le potentiel de référence valent, pour chacun des degrés d'oxydation (à noter le signe − qui apparait dans le cas de l'ion chlorure) :
- Cl− : −1,36
- Cl2 : 0
- HClO : 1,63
- HClO2 : 4,97
- ClO3− : 7,34
- ClO4− : 9,74
Ces produits représentent l'enthalpie libre de formation ΔfG° de chaque composé divisée par F.
Cela permet d'obtenir le graphe suivant[1] :

Utilisation prédictive du diagramme
Détermination des potentiels d'électrode standard
Ce diagramme est un outil simple qui permet de déterminer les potentiels rédox de tous les couples rédox pouvant exister entre les divers composés du chlore.
Par exemple, on détermine le potentiel rédox E° du couple HClO2/Cl−.
Celui-ci répond à l'équation :
- ΔrG°(HClO2 → Cl−) = −n·F·E°(HClO2/Cl−)
En appliquant le premier principe de la thermodynamique :
- ΔrG°(HClO2 → Cl−) = ΔrG°(HClO2 → ½ Cl2) + ΔrG°(½ Cl2 → Cl−)
Or, on connaît ΔrG°(HClO2 → ½ Cl2) qui vaut +3F·E°(HClO2/Cl2) =4,97·F, d'après la demi-équation rédox :
- HClO2 + 3 e− + 3 H+ → ½ Cl2 + 2 H2O
De même, ΔrG°(½ Cl2 → Cl−) vaut F·E°Cl2/Cl−) = 1,36 F
Donc ΔrG°(HClO2 → Cl−) = 4,97 F + 1,36 F = 6,33 F, pour la demi-équation rédox suivante :
- HClO2 + 4 e− + 3 H+ → Cl− + 2 H2O
où s'échangent quatre électrons.
On obtient donc la relation :
- ΔrG°(HClO2 → Cl−) = −4 F·E°(HClO2/Cl−) = 6,33 F
ou
- E°(HClO2/Cl−) = 6,33/4 = 1,583 V
L'application de ce même raisonnement permet de voir que le potentiel redox d'un couple donné est égal au coefficient directeur de la droite qui relie les points représentatifs sur le diagramme de Frost des deux membres de ce couple.
Exemple :
- E°(ClO4−/ClO3−) = (9,74 − 7,34)/2 = 1,2 V
On peut obtenir le même résultat très simplement parce que les ordonnées associées à chaque espèce représentent en fait leur enthalpie libre de formation divisée par F. Ainsi,
- ΔrG°1→2 = ΔfG°2 − ΔfG°1
Donc
- (n2 − n1)F·E°1→2 = n2F·E°2 − n1F·E°1
Ou
- E°1→2 = (n2E°2 − n1E°1)/(n2 − n1)
L'application à l'exemple précédent donne bien 1,2 V.
Dismutation - Médiamutation
Il est facile de déterminer l'enthalpie libre d'une réaction donnée grâce aux valeurs de ΔG°/F données par le diagramme.
On cherche à savoir si HClO2 est stable à pH = 0. Pour cela, on étudie les réactions qui peuvent conduire à sa dismutation en Cl− et ClO3− par exemple. La réaction considérée est la suivante :
- x HClO2 +… → y ClO3− + z Cl− +…
dont on va obtenir les coefficients en écrivant les demi-équations rédox :
- HClO2 + H2O → ClO3− + 3 H+ + 2 e−
- HClO2 + 3 H+ + 4 e− → Cl− + 2 H2O
en multipliant par 2 la première demi-équation, on peut additionner les deux en éliminant les électrons. Il vient :
- 3 HClO2 → 2 ClO3− + Cl− + 3 H+ (A)
L'enthalpie libre ΔrG°A de cette réaction vaut, à pH=0 :
- ΔrG°A = 2 ΔfG°(ClO3−) + ΔfG°(Cl−) − 3 ΔfG°(HClO2)
soit
- ΔrG°A = F·(2·7,34 + (−1,36) − 3·4,97) = −1,59F (joules)
soit une enthalpie libre négative, ce qui indique que HClO2 est instable en milieu acide et se dismute.
Tracé du diagramme à d'autres pH
Grâce à l'équation de Nernst, on peut déterminer les potentiels rédox standard à un pH quelconque, connaissant les constantes d'acidité des composés mis en jeu.
Tracés pour d'autres éléments
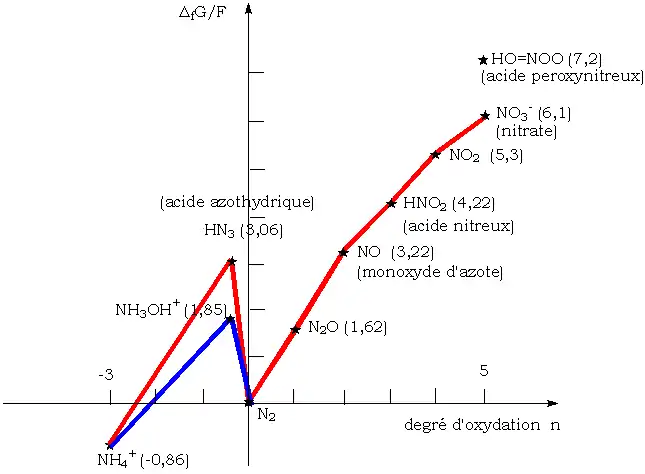
Diagramme de frost de l'azote à pH = 0
Notes et références
- Réalisé avec le logiciel Paint de Microsoft.
- Portail de la chimie