Cortex cingulaire antérieur
Le cortex cingulaire antérieur (CCA) est la partie frontale du cortex cingulaire, qui ressemble à un « collier » s'enroulant autour du corps calleux (dont les fibres relaient les signaux neuronaux entre les hémisphères cérébraux droit et gauche).
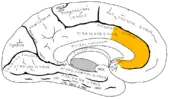

Il comprend une zone ventrale et une zone dorsale. Il semble jouer un rôle dans une grande variété de fonctions autonomes comme la régulation de la pression artérielle et du rythme cardiaque, de fonctions cognitives, telles que l'anticipation de récompense, la prise de décision, l'empathie et l'émotion.
Anatomie

Le cortex cingulaire est une région du cerveau structurellement hétérogène. La division du cortex cingulaire en deux parties, l'antérieure et la postérieure, a été faite par Brodmann en 1909 sur la base d'une différence anatomique et en ignorant les fonctions de ces régions.
La partie antérieure du cortex cingulaire (ou CCA) peut être distinguée de la partie postérieure (CCP) sur la base de sa connectivité et de sa cytoarchitecture. On oppose alors la fonction exécutive du CCA à la fonction évaluative du CCP[1].
Le cortex cingulaire antérieur peut être divisé anatomiquement en une partie dorsale aux fonctions cognitives et une partie rostrale-ventrale aux fonctions émotionnelles[2].
- la division dorsale cognitive, CCAd, comprend les aires de Brodmann AB 24' et 32'[N 1]. Cette région fait partie d'un réseau distribué attentionnel, maintenant des interconnexions fortes avec le cortex préfrontal latéral (AB 49/9), le cortex pariétal (AB 7) et l'aire motrice supplémentaire et l'aire prémotrice, ce qui en fait une station centrale de traitement pour des stimuli montants et descendants et d'affectation de contrôle vers d'autres zones du cerveau.
- la division rostrale-ventrale affective, comprend les aires AB 24, 32, 25 (périgénuale) et 33 (enfouie dans le sillon supracallosal).
Cette région est connectée à l'amygdale, à la substance grise périaqueducale, au noyau accumbens, à l'hypothalamus, l'insula antérieure, l'hippocampe et au cortex orbitofrontal.
Physiologie
Le CCA est impliqué dans certains processus cognitifs comme la sélection de la réponse motrice et dans les comportements émotionnels.
- Le CCAd cognitif joue un rôle dans la modulation de l'attention et des fonctions exécutives, dans le contrôle de la compétition, de la motivation, dans la détection d'erreurs et dans la mémoire de travail.
- Le CCA affectif est impliqué dans l'évaluation de la pertinence des informations émotionnelles et dans la régulation des réponses émotionnelles.
Une activation d'une division s'accompagne souvent d'une désactivation de l'autre division[2]. Ainsi dans une tâche de comptage de Stroop[N 2], le signal IRMf augmente dans la division cognitive et diminue dans la division affective. Pour une tâche de Stroop émotionnelle[N 3], c'est l'inverse. La désactivation de la division cognitive s'observe aussi chez les individus souffrant d'une dépression sévère et chez les sujets normaux anticipant une douleur.
Dissonance cognitive
Lors d'une expérience entraînant une dissonance cognitive le CCA est activé et ce d'autant plus que le conflit est important[3].
Le CCA dorsal cognitif
Le CCAd est impliqué dans le contrôle cognitif et l'affect de la douleur.
Détection de conflits, d'erreurs de prédictions
Les sujets effectuant une tâche de Stroop (« dire rapidement la couleur de l'encre ») commettent plus facilement des erreurs, du fait de l'automaticité de la lecture, dans les cas incompatibles (rouge) que dans les cas compatibles (rouge). Il est apparu que le CCA est plus actif dans les conditions incompatibles que dans les conditions compatibles. Le CCA est aussi plus actif lorsque les sujets commettent une erreur que lorsqu'ils ne se trompent pas[4]. Chez le singe comme chez l'homme, une lésion du CCAd (dorsal) diminue la capacité à corriger des réponses incorrectes[5]. Le CCAd détecte les conflits entre différentes réponses comportementales possibles et transmet cette information au cortex préfrontal : « le CCAd signale à l'individu que les événements consécutifs à une action sont plus mauvais que ceux attendus et qu'il lui faudra changer de stratégie dans les situations identiques ultérieures »[6].
L'activité du CCA accrue chez les singes (généralement associée à une réduction de l'utilisation de dopamine) réduisait la capacité d'apprendre à utiliser des indices visuels pour l'anticipation de récompenses[réf. nécessaire].
Douleur

De nombreuses études ont mis en évidence l'implication du CCAd dans la perception subjective de la douleur. Lorsqu'un stimulus douloureux est appliqué sur une partie du corps (ex. : la piqûre d'un orteil), les informations nociceptives sont transmises au cerveau suivant deux voies ascendantes[7] :
- une voie aboutissant au cortex somesthésique (aires somatiques primaire SI et secondaire SII du lobe pariétal) qui renseigne sur l'emplacement, l'intensité et la nature de la stimulation douloureuse ;
- une voie aboutissant au système limbique (aire 24 du CCA et insula) qui donne la dimension affective, motivationnelle, en provoquant une sensation désagréable (pour le CCAd) et en donnant une dimension discriminative (pour le cortex insulaire).
L'étude des potentiels évoqués nociceptifs a montré que l'information nociceptive parvenait dans le cortex pariétal bien avant d'arriver dans le cortex frontal interne[N 4],[8].
Le rôle du CCA dorsal dans l'encodage de l'affect douloureux est confirmé par une étude utilisant l'hypnose pour suggérer une douleur plus ou moins forte associée à la même stimulation nociceptive[9]. La tomographie TEP a révélé une plus grande activation du CCAd quand le sujet dit ressentir une plus grande souffrance alors que l'activation du cortex somatosensoriel reste identique (car le stimulus est le même). Quand des sujets s'infligent eux-mêmes une douleur, l'activation est moins forte que quand ils subissent la même douleur. L'activité du CCA est inhibée dans le premier cas[10] Les cingulotomies[N 5] pratiquées pour traiter des troubles psychiatriques, s'accompagnent d'une diminution de l'affect douloureux mais d'une préservation de l'aptitude à localiser le stimulus[11], confirmant ainsi l'hypothèse que le CCAd ne localise pas l'affect. La dissociation affectif/discriminatif inverse a été observée chez un patient ayant une lésion postcentrale droite à la suite d'un AVC[12]. A une stimulation cutanée thermique délivrée par laser sur la main gauche, le patient réagit en la déclarant « franchement désagréable » se produisant « quelque part entre le bout du doigt et l'épaule ». Il était aussi incapable de dire si c'était « brûlant, glacé, piquant, une légère ou une forte douleur ».
Chez la souris, une lésion du CCA empêche les conséquences anxiodépressives de la douleur chronique sans affecter l'allodynie sensorielle mécanique[13].
Cette division CCAd manifeste aussi une dimension cognitive de l'expérience douloureuse. L'aire BA 24 reflète le déplacement de l'attention sur le stimulus douloureux et l'aire BA 32 se manifeste seulement dans le cas d'une attention dirigée volontaire et soutenue vers le lieu d'origine du stimulus douloureux.
Lors d'un jeu informatique provoquant un sentiment d'exclusion sociale, le paracétamol diminuait la douleur physique ou morale et diminue l'activité du CCA[14]
Colère
Le CCAd est aussi relié à l'expérience subjective ressentie par un sujet subissant une provocation directe, une insulte ou toute attitude irrespectueuse capable de déclencher la colère[15].
Le CCA rostral-ventral affectif

Des nombreuses études d'imagerie fonctionnelle ont montré l'activation de CCA rostral lors de l'induction d'émotions chez des sujets sains[16].
L'évocation d'expériences personnelles douloureuses provoquent une grande tristesse et s'accompagnent d'un accroissement du débit sanguin cérébral régional (DSCr) dans l'aire 25 de Brodmann (CCA périgénuale) et l'insula ainsi qu'une diminution du DSCr dans les régions préfrontale dorsolatérale droite (AB 46/9) et pariétale inférieure (AB 40)[17]. Ces changements inverses, d'activation dans les régions limbiques (CCAr, insula) et de désactivation des régions corticales (préfrontale, pariétale), correspondent au récit d'évaluation « à chaud » des sujets indiquant avoir vécu intensément l'émotion en oubliant en partie leur environnement, conformément à de nombreuses observations liant humeur négative et distraction de l'attention.
Le CCA sousgénuale est la région se trouvant dessous le genou du corps calleux, formée de l'aire AB 25 et de petites portions des AB12, 32 et 33. Le CCA sousgénuale est un centre de contrôle autonome. Il répond aux émotions et détermine l'expression autonomes des émotions[18].
Activités associée à une modulation de l'activité du CCA
Méditation
La pratique de la méditation augmenterait la capacité à observer ses sensations. Elle augmenterait l'épaisseur du CCA et diminuerait la sensibilité à la douleur[19]. La pratique d'un entraînement intégrant l'esprit et le corps basé sur la médecine chinoise (integrative body-mind training) augmente l'activité du CCA, améliore l'auto-régulation ainsi que l'efficacité et l'intégrité de la corona radiata qui lie le CCA à d'autres structures cérébrales[20].
Politique
Le CCA serait plus développé chez les électeurs libéraux que chez les conservateurs et serait impliqué dans une meilleure capacité à s'adapter à la nouveauté[21][réf. à confirmer].
Activité criminelle
Chez certains criminels, l'activité du CCA est plus faible. Ceci réduit leur capacité à maîtriser leurs actes[22].
Pathologie
Les lésions du CCA produisent une incapacité à détecter des erreurs, apathie, une inattention, un mutisme akinétique, des dérégulations des fonctions du système autonome, une instabilité émotionnelle, une disparition de la détresse, des pleurs compulsifs et des déficits cognitifs par exemple pour résoudre des stimulus contradictoires comme les tâches de Stroop[réf. nécessaire].
Schizophrénie
On retrouve des lésions du CCA chez les patients schizophrènes. Les patients ont des difficultés à faire face à des localisations spatiales contradictoires dans une tâche proche d'un Stroop. Ils avaient des ERNs perturbées[réf. nécessaire].
Trouble obsessionnel compulsif
On retrouve une activité du glutamate[pas clair] plus basse dans cette région dans le trouble obsessionnel compulsif[23] alors qu'on observe une hyperactivité glutamatergique dans d'autres régions.
Trouble du déficit de l'attention
Des lésions du cortex cingulaire antérieur peuvent créer des déficits du contrôle de l'attention, semblable à ceux observable dans le trouble du déficit de l'attention hyperactif (TDAH). On peut observer ces déficits lors de certains accidents vasculaires cérébraux (AVC), engendrant un déficit traité par rééducation cognitive[24].
Autisme
Des anomalies du développement du cortex cingulaire, associé à des anomalies dans le cortex dorsal médio-frontal pourraient être liées aux déficits socio-cognitifs dans l'autisme comme la compréhension sociale et l'attention conjointe[25].
Douleur chronique
Le CCA intervient dans la persistance d'une douleur chronique. Les neurones restent plus actifs. L'inactivation par la molécule ZIP pourrait inhiber cet apprentissage[26].
Notes
- le prime dans AB 24' indique la partie dorsale de AB 24.
- consistant à compter le nombre de mots (numérique ou neutre) dans une boîte deux deux deux (réponse : 3) versus chat chat chat.
- cette tâche consiste à identifier la couleur de l'encre des mots ayant une valeur sémantique anxiogène, comme cancer (réponse : rouge).
- l'information nociceptive parvient dans SI et SII controlatéral en 100-110 ms, dans le cortex ipsilatéral en 110-120ms et dans le cortex frontal interne en 250 ms.
- opération consistant à retirer (on parle résection) le cortex cingulaire.
Références
- Brent A. Vogt, David M. Finch and Carl R. Olson, « Functional Heterogeneity in Cingulate Cortex: The Anterior Executive and Posterior Evaluative Regions », Cerebral Cortex, vol. 2, no 6, .
- Bush G, Luu P, Posner MI., « Cognitive and emotional influences in anterior cingulate cortex », Trends Cogn Sci., vol. 4, no 6, .
- Van Veen, V., Krug, M.K., Schooler, J.W., & Carter, C.S. (2009). Neural activity predicts attitude change in cognitive dissonance. Nature Neuroscience, 12(11), 1469–1474.
- Carter, C. S., Braver, T. S., Barch, D. M., Botvinick, M. M., Noll, D. et Cohen, « Anterior cingulate cortex, error detection, and the on-line monitoring of performance. », Science, vol. 280, .
- Diane Swick and And U. Turken, « Dissociation between conflict detection and error monitoring in the human anterior cingulate cortex », PNAS, vol. 99, no 25, .
- Hélène Ollat, « Les fonctions du cortex cingulaire antérieur dorsal », Neuropsychiatrie : Tendances et Débats, vol. 26, (lire en ligne [PDF]).
- Dale Purves, G-J Augustine, D. Fitzpatrick, W-C Hall, LaManta, McNamara, Williams, Neurosciences, De Boeck, , 811 p..
- Laure Mazzola, Bernard Laurent et Roland Peyron, « Intégration corticale de la douleur et apport de l’imagerie fonctionnelle », dans "Ensemble face à la douleur Prévention, traitement et prise en charge" Elsevier / Masson, (lire en ligne [PDF]).
- Rainville P, Duncan GH, Price DD, Carrier B et Bushnell MC., « Pain affect encoded in human anterior cingulate but not somatosensory cortex. », Science, vol. 277, , p. 968-971.
- Y. Wang et al., PloSOne, vol. 6, p. 23, 536, 2011.
- R. Peyron, B. Laurent, L. García-Larrea, « Functional imaging of brain responses to pain. A review and meta-analysis (2000) », Neurophysiol Clin, vol. 30, , p. 263-88.
- M. Ploner, H.-J. Freund, A. Schnitzler, « Pain affect without pain sensation in a patient with a postcentral lesion », Pain, vol. 81, , p. 211-214.
- Ipek Yalcin Christmann et al. « The anterior cingulate cortex is a critical hub for pain-induced depression». Biol Psychiatry, pii: S0006-3223(14)00597-6. DOI:10.1016/j.biopsych.2014.08.004, 2014.
- N. DeWall et al., in Psychological Science, vol. 21, p. 931, 2010.
- Denson TF, Pedersen WC, Ronquillo J, Nandy AS., « The angry brain: neural correlates of anger, angry rumination, and aggressive personality. », J Cogn Neurosci., vol. 21, no 4, , p. 734-744.
- Hélène Ollat, « Le cortex cingulaire antérieur à l'interface de l'émotion et de la cognition Les données de la neuroimagerie », Neuropsychiatrie : Tendances et Débats, vol. 23, (lire en ligne).
- Helen S. Mayberg, M.D., Mario Liotti, M.D., Ph.D., Stephen K. Brannan, M.D., Scott McGinnis, B.S., Roderick K. Mahurin, Ph.D., Paul A. Jerabek, Ph.D., J. Arturo Silva, M.D., Janet L. Tekell, M.D., Charles C. Martin, Ph.D., Jack L. Lancaster, Ph.D., and Peter T. Fox, M.D., « Reciprocal Limbic-Cortical Function and Negative Mood: Converging PET Findings in Depression and Normal Sadness », Am J Psychiatry, vol. 156, no 5, .
- Neafsey, Edward J.; Terreberry, Robert R.; Hurley, Karen M.; Ruit, Kenneth G.; Frysztak, « Anterior cingulate cortex in rodents: Connections, visceral control functions, and implications for emotion. », in Vogt, Brent Alan (Ed); Gabriel, Michael (Ed). Neurobiology of cingulate cortex and limbic thalamus: A comprehensive handbook, (pp. 206-223). Cambridge, MA, US: Birkhäuser, xiii, 639 pp., .
- J. Grant et al., in Emotion, vol. 10, p. 43, 2010.
- Yi-Yuan Tang, « Short-term meditation induces white matter changes in the anterior cingulate », Proceedings of the National Academy of Sciences, , p. 201011043 (ISSN 0027-8424 et 1091-6490, PMID 20713717, DOI 10.1073/pnas.1011043107, lire en ligne, consulté le ).
- R. Kanai et al., in Current Biology, vol. 21, p. 677, 2011.
- E. Aharoni et al. Neuroprediction of future rearrest, PNAS, vol. 110, p. 6223, 2013.
- Bush G, Frazier JA, Rauch SL, et al., « Anterior cingulate cortex dysfunction in attention-deficit/hyperactivity disorder revealed by fMRI and the Counting Stroop », Biol. Psychiatry, vol. 45, no 12, , p. 1542–52 (PMID 10376114, DOI 10.1016/S0006-3223(99)00083-9, lire en ligne).
- « Rééducation cognitive pour les troubles de l'attention après un AVC », sur www.cochrane.org (consulté le )
- Peter Mundy, « Annotation: The neural basis of social impairments in autism: the role of the dorsal medial-frontal cortex and anterior cingulate system », Journal of Child Psychology and Psychiatry, vol. 44, no 6, , p. 793–809 (DOI 10.1111/1469-7610.00165, lire en ligne).
- Xiang-Yao Li et al., Alleviating neuropathic pain hypersensitivity by inhibiting PKMζ in the anterior cingulate cortex, Science, vol. 330, pp. 1400-1404, 3 décembre 2010.
Voir aussi
Articles connexes
Bibliographie
- Nicolas Bourret, Thomas Michelet, Dominquue Guehl, Bruno Aouizerate, Pierre Burbaud, Jean-Didier Vincent, Pierre Rondot, Roger Nordmann et Bernard Lechevalier, « Le cortex cingulaire antérieur dans la détection des erreurs et la gestion des conflits. Analyse de l'activité neuronale chez le singe », Bulletin de l'Académie nationale de médecine, 2005, vol. 189, no 7, p. 1529-1540.
- E. Procyk et J. P. Joseph, « Le cortex cingulaire antérieur en situations routinières et non routinières » [chez le singe], La Lettre du neurologue, 2002, vol. 6, no 1, p. 30-31.
Liens externes
- « Les fonctions du cortex cingulaire antérieur dorsal »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) (article d'Hélène Ollat dans Neuropsychiatrie : tendances et débats 2005, n° 26, p. 15-21)
- Portail des neurosciences
- Portail de la médecine
- Portail des cétacés
- Portail de l’anatomie