Cancer de la thyroïde
Le cancer de la thyroïde est un cancer qui touche l'un des différents types cellulaires composant la thyroïde. Bien qu'il soit l'un des principaux cancers endocriniens, 95 % des nodules thyroïdiens s’avèrent bénins[1].

| Spécialité | Oncologie |
|---|
| CIM-10 | C73 |
|---|---|
| CIM-9 | 193 |
| MedlinePlus | 001213 |
| eMedicine | 851968 |
| eMedicine | ent/646 |
| MeSH | D013964 |
| Causes | Rayonnement ionisant, iode 131 et néoplasie endocrinienne multiple de type 2 (en) |
| Médicament | Mésilate de lenvatinib (d), vandétanib (en), cabozantinib, thyrotropine alfa (d), vandétanib (en) et tiratricol (en) |
![]() Mise en garde médicale
Mise en garde médicale
Parmi les 5 % restants, qui sont des tumeurs malignes, il existe plusieurs types histologiques de cancers thyroïdiens [1] :
- les carcinomes différenciés (90 %) : papillaires (les plus fréquents, avec plus de 80 % des cancers thyroïdiens déclarés) et vésiculaires (ou folliculaires de l'anglais follicular), qui se développent à partir de cellules qui conservent leur aspect et leurs fonctions d'origines (production d'hormones thyroïdiennes et fixation de l'iode), sont peu agressifs et d'évolution lente ;
- les carcinomes indifférenciés ou anaplasiques où les cellules ont perdu la plupart de ces fonctionnalités, sont très rares et surtout retrouvés chez des sujets âgés ;
- les carcinomes médullaires, rares, qui se développent à partir de cellules particulières de la thyroïde, les cellules parafolliculaires ou cellules C.
Ce cancer endocrinien ne compte pas parmi les plus fréquemment détectés en France, mais sa prévalence semble en forte augmentation, notamment en raison d'une amélioration du dépistage[2]. Il fait partie des cancers qui augmentent le plus, avec, par exemple en France, depuis les années 1970, plus de 3 800 nouveaux cas par an, touchant principalement des femmes, mais tout en ayant une mortalité qui reste stable voire en légère diminution[1].
Grâce aux progrès des techniques diagnostiques, de l'endocrinologie et des techniques thérapeutiques comme la chirurgie, le pronostic de ce cancer est globalement excellent[1] ; la survie relative à 5 ans des patients, tous stades et tous types histologiques confondus, s’élève à 94 %[3].
Épidémiologie
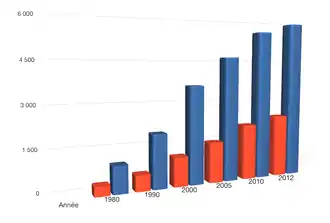
Incidence
Comme d'autres cancers dits « hormonaux » (cancer du sein, cancer du testicule, une partie des cancers du pancréas et du rein), c'est-à-dire touchant des glandes importantes du système endocrinien[5], c'est un des cancers qui sont en augmentation régulière[6].
En 1985 (à la veille de l’accident de Tchernobyl), d’après les données du réseau FRANCIM, l’incidence, en France, était de l’ordre de 1,3 pour 100 000 chez les hommes et de 3,4 chez les femmes.
En 1975, l’incidence était de l’ordre de 0,5 pour 100 000 chez l’homme et de 2,1 pour 100 000 chez la femme.
En 1995, l’incidence était respectivement de 3,1 et de 5,7 pour 100 000.
Le nombre de cancers de la thyroïde est en augmentation. On compte désormais 1 500 à 2000 nouveaux cas par an[7].
Une analyse affinée selon le type de cancer montre que ce sont les cancers « papillaires » qui sont en forte hausse depuis les années 1980[8] (augmentation qui persiste dans les années 2010 chez les hommes, alors qu'elle s'atténue chez les femmes depuis peu. Les statistiques montrent toutefois de fortes disparités géographiques pour le risques comme pour la tendance à la hausse[8]. L'évolution de l’incidence et la mortalité divergent en raison du fait qu'il existe d’importantes différences de survie selon le type histologique de cancer[9] : les cancers papillaires sont en forte hausse en France et ont une incidence élevée, mais leur pronostic est très favorable, alors que les cancers anaplasiques sont plus rares et leur incidence tend en outre à diminuer cependant leur pronostic très défavorable marque encore les statistiques de mortalité[10].
Son incidence augmente dans de nombreux pays depuis les années 1960 et pour des raisons mal comprises, qui pourraient éventuellement partiellement au moins impliquer les retombées des essais nucléaires atmosphériques (qui ont atteint leur maximum en 1961) ; ainsi en France, selon les registres du cancer et données disponibles analysées par l'InVS en 2006, « à âge égal, les femmes nées en 1960 ont un risque de cancer de la thyroïde 8 fois plus élevé que celles nées en 1928 (année de référence). Ce risque passe à 20 pour les cancers papillaires »[6]. Une part de cette augmentation est due à une meilleure détection et à des ablations ou opérations plus fréquentes ou précoces sur les nodules thyroïdiens[11].
Une sur-incidence a été constatée ; tout particulièrement (80 % des cas) chez ceux qui étaient des enfants âgés de 0 à 4 ans au moment de l’accident dans les pays les plus exposés[12], dans les zones les plus touchées par les retombées de Tchernobyl (en Biélorussie notamment), mais pas dans les zones faiblement touchées ni en France dans l'Est du pays d'après les données disponibles en 2000[13] et 2006[6] dans le cadre du dispositif de surveillance épidémiologique mis en place en France pour évaluer les conséquences sanitaires de l’accident de Tchernobyl en France[14] et dans le cadre de la surveillance générale de l'incidence des « cancers thyroïdiens »[15] et de leur mortalité induite[16]. En 1999, 163 hommes et 298 femmes en sont décédées en France alors que le nombre de nouveaux cas annuellement détectés était de 500 pour les hommes et 2 000 pour les femmes en l'an 2000[2].
Facteurs de risques
Les facteurs de risques sont :
- exposition à des rayonnements ionisants, principalement pendant l’enfance, externe ou interne (particules inhalées ou ingérées) ;
- carence en iode ;
- être une femme ; les femmes sont plus fréquemment touchées que les hommes, sauf en Corse depuis quelques décennies, pour des raisons à ce jour non-expliquées[6].
D'autres facteurs, ainsi que l'effet de leurs interactions, sont suspectés. Ils sont d'ordre nutritionnels, reproductifs, menstruels, hormonaux et anthropométriques. Dans une moindre mesure sont évoqués les polluants chimiques (pesticides, etc.), un contexte d'endémie goitreuse ainsi qu'une prédisposition génétique.
L’irradiation de la thyroïde augmente le risque de cancer de la thyroïde en particulier chez l’enfant et l’adolescent : le facteur d’augmentation est de 80 % pour une dose de 1 000 mSv, les filles sont deux à trois fois plus sensibles que les garçons. Ce risque devient faible vers l’âge adulte et disparaît vers 35 ans[17].
Les retombées des essais nucléaires atmosphériques, y compris ceux qui furent menés dans le Pacifique (campagnes commencées avant la catastrophe de Tchernobyl), sont reconnues comme une des causes de l'augmentation observée de ce type de cancer[18].
Le passage du nuage radioactif de Tchernobyl et l'augmentation du nombre de cancers de la thyroïde en France métropolitaine ont fait l'objet d'études qui ne semblent pas établir de lien direct de cause à effet[19].
Une étude de l'Institut de veille sanitaire publiée en 2001 n'excluait pas la possibilité d’un faible excès de cancers de la thyroïde en France lié à cet accident. Le bilan sur 25 ans de l'évolution de l’incidence du cancer de la thyroïde en France métropolitaine publié en 2011 utilise des données fournies par l'IRSN et exclut un impact important des retombées de Tchernobyl[20]. Une étude, en cours, vise à estimer l'impact des retombées de Tchernobyl sur le risque de cancer de la thyroïde en France. Elle est focalisée sur les enfants résidant dans l'Est de la France au moment de l'accident et réalisée en collaboration étroite entre l’INSERM et l'IRSN[20].
Anatomo-pathologie

Quatre types de cancer thyroïdien sont décrits : le cancer papillaire est de loin le plus fréquent, suivi par le cancer folliculaire. Les cancers anaplasiques et médullaires sont les plus rares.
Diagnostic
Symptômes
Les symptômes :
- apparition progressive
- d'un nodule (masse) de la région médiane du cou,
- d'une adénopathie latéro-cervicale,
- modification récente d'un goitre thyroïdien existant et ancien ;
- otalgie réflexe persistante (sans cause au niveau de l'oreille) ;
- très rarement des troubles hormonaux révèlent le cancer :
- bouffées vaso-motrices cervico-faciale, diarrhée motrice, hypertension artérielle instable se retrouvent dans le cadre d'un cancer médullaire de la thyroïde,
- l'hypothyroïdie,
- l'hyperthyroïdie,
- modification de la voix (dysphonie) en rapport avec une paralysie de la corde vocale (compression du nerf récurrent).
Examens cliniques
Des outils de diagnostic différentiel apparaissent, avec notamment en 2004 un test de détection moléculaire, créé en France par le CEA, détectant les signatures moléculaires propres à différencier les 3 types de tumeur de la thyroïde, grâce à une puce à ADN, permettent d'affiner le diagnostic, et mieux orienter la médication ou la chirurgie (en différenciant mieux tumeur bénigne et maligne)[21].
Examens complémentaires
L'échographie thyroïdienne permet de suspecter un cancer, surtout si le nodule a un diamètre supérieur à 2 cm, est plein et comporte des microcalcifications[22].
Le diagnostic est anatomopathologique, soit à l'aide d'une biopsie, soit sur une pièce opératoire.
Prise en charge
Traitements médicaux
La prise en charge des cancers de la thyroïde a fait l'objet de la publication de recommandation par l' American Thyroid Association en 2009[23] et par la European Society of Endocrinology en 2006[24].
Chirurgical
Il existe plusieurs variantes de thyroïdectomie
Le type de thyroïdectomie à privilégier fait toujours débat, en particulier en ce qui concerne la nécessité d'une thyroïdectomie totale ou subtotale pour les formes à plus bas risque[25]. La thyroïdectomie totale (ou sub totale) doit être préférée dans les cancers papillaire de plus d'un centimètre[26].
Un curage ganglionnaire cervical peut être associé à la thyroïdectomie et son caractère extensif dépend de l'envahissement ganglionnaire régional existant, récurrentiel ou jugulo-carotidien. Son intérêt dans les formes à bas risque n'est cependant pas établi[27].
Médical
- iode radioactif (radiothérapie interne) : Pour soigner ce cancer, l'iode 131 était avant 2006 (avec l’exérèse chirurgicale de la thyroïde) le premier traitement, et il était proposé presque systématiquement par les services de médecine nucléaire (à tout stade de la tumeur au moment du diagnostic). Ce traitement est particulièrement efficace chez le patient jeune, dans les formes captant l'iode et avec de petites métastases[28]. Ce traitement dont l'efficacité n'est pas contestée n’avait cependant jamais été scientifiquement évalué en terme risques/bénéfices (conséquences secondaires différées en particulier). Il existe cependant une augmentation de risque de second cancer à moyen et long terme. De plus, un certain nombre de cancers ne captent pas l'iode ce qui rend inefficace ce traitement.
- radiothérapie externe
- chimiothérapie
- Le traitement substitutif aux hormones thyroïdiennes est naturellement indispensable, la thyroïdectomie totale ou l'iode radioactif pouvant entraîner une hypothyroïdie. De plus, les cancers différenciés conservent des récepteurs à la TSH et le niveau sanguin de ce dernier est corrélé avec le risque de cancer de la thyroïde ainsi qu'avec des formes plus agressives[29]. Donner des hormones thyroïdiennes pour parvenir à baisser le taux de TSH en deçà de la normale (équivalent à une hyperthyroïdie modérée) semble améliorer le pronostic[30].
Pronostic
| Type du Cancer thyroïdien | Taux de survie à 5 ans | Taux de survie à 10 ans | ||||
|---|---|---|---|---|---|---|
| Stade de cancer I | Stade II | Stade III | Stade IV | Total | Total | |
| Papillaire | 100 %[31] | 100 %[31] | 93 %[31] | 51 %[31] | 96 %[32] ou 97 %[33] | 93 %[32] |
| Folliculaire | 100 %[31] | 100 %[31] | 71 %[31] | 50 %[31] | 91 %[32] | 85 %[32] |
| Médullaire | 100 %[31] | 98 %[31] | 81 %[31] | 28 %[31] | 80 %[32], 83 %[34] ou 86 %[35] | 75 %[32] |
| Anaplasique | (toujours stade IV)[31] | 7 %[31] | 7 %[31] ou 14 %[32] | ND | ||
Suivi des patients
Un consensus professionnel a été établi en Europe[36].
Prévention
Pistes de recherche
La resensibilisation de la tumeur à l'iode, permettant une sensibilité à l'iode radioactif sur une tumeur précédemment résistante, est une voie de recherche. Des tests avec un acide rétinoïque[37] montrent une resensibilisation dans un cinquième des cas. Le selumetinib semble prometteur[38].
Une étude de 2019 met en évidence des interactions croisées entre fibroblastes et cellules tumorales, qui augmentent les capacités de prolifération et d'invasion des cellules malignes dans la forme anaplasique, ouvrant la voie à de nouvelles pistes de traitement[39],[40].
Notes et références
- Schlumberger M., « GRAND PUBLIC : Le cancer de la thyroïde », La Ligue contre le cancer, (résumé)
- Catherine Hill, Françoise Doyon « Fréquence des cancers en France » Bulletin du Cancer 2003;90(3):207-13. (résumé), voir notamment tableau de la page 211
- « ALD 30 – Tumeur maligne, affection maligne du tissu Lymphatique ou hématopoïétique Cancer de la thyroïde », Guide – affection de longue durée, Institut National du Cancer, (lire en ligne)
- INVS Binder-Foucard F & al. (2013) Estimation nationale de l’incidence et de la mortalité par cancer en France entre 1980 et 2012. Partie 1 – Tumeurs solides. Saint-Maurice (Fra) : Institut de veille sanitaire, 2013. 122 p. (ISBN 978-2-11-138316-6 et 978-2-11-138317-3)
- Parkin DM, Whelan SL, Ferlay J. et al. Cancer in Five Continents. Iarc Scientific Publications; no 155 (vol. VIII), Lyon 2002.
- Laurence Chérié-Challine et les membres du comité de rédaction (2006) « Surveillance sanitaire en France en lien avec l’accident de Tchernobyl », Bilan actualisé sur les cancers thyroïdiens et études épidémiologiques en cours en 2006 ; (ISBN 2-11-096297-6)
- Impact Médecin Hebdo, n° 396, 3 février 1998
- Colonna M, Belot A, Uhry Z (2010) Incidence des cancers de la thyroïde à partir des données des registres du cancer : description sur la période 1982-2006. In: Rogel A, Colonna M, Uhry Z, Lacour B, Schwartz C, Pascal L, et al. (2010) Évolution de l’incidence du cancer de la thyroïde en France métropolitaine – Bilan sur 25 ans. Saint-Maurice : Institut de veille sanitaire ; 2010. p. 8-16. Disponible à partir de l’URL : http://www.invs.sante.fr
- Jooste V, Grosclaude P, Remontet L, Launoy G, Baldi I, Molinié F, et al. (2013) Unbiased estimates of long-term net survival of solid cancers in France. Int J Cancer |132(10):2370-7.
- Colonna M, Bossard N, Guizard AV, Remontet L and the Francim network (2010). Descriptive epidemiology of thyroid cancer in France: incidence, mortality and survival. Ann Endocrinol | 71(2):95-101.
- Grosclaude P, Chérié-Challine L. Increased incidence in thyroid carcinoma in France : a true epidemic or nodulemanagement effects ? Report of the French thyroid cancer committee. Thyroid 2004;14:1056-60.
- (en) Leenhardt L, Aurengo A. « Post Tchernobyl thyroid carcinoma in children » Baillière’s Clin Endocrinol Metab. 2000;14:667-77.
- Remontet L, Buemi A, Velten M, Jougla E, Estève J. (2002), Évolution de l’incidence et de la mortalité par cancer en France de 1978 à 2000. Rapport Francim-HCL-Inserm-InVS, éditions InVS, Paris
- Verger P, Chérié-Challine L. et al. Évaluation des conséquences sanitaires de l’accident de Tchernobyl en France : dispositif de surveillance épidémiologique, état des connaissances, évaluation des risques et perspectives. Rapport IPSN-InVS. Réf. IPSN/OO-15a, éditions InVS, Paris, décembre 2000
- Leenhardt L, Grosclaude P, Chérié-Challine L. et al. Mise en place d’un dispositif de surveillance épidémiologique nationale des cancers thyroïdiens. Rapport intermédiaire, 2001, et final, 2003, éditions InVS, Paris
- Remontet L, Buemi A, Velten M, Jougla E, Estève J. Évolution de l’incidence et de la mortalité par cancer en France de 1978 à 2000. Rapport Francim-HCL-Inserm-InVS, éditions InVS, Paris, 2002
- http://www.assemblee-nationale.net/legislatures/11/pdf/rap-oecst/i3571.pdf
- (en) de Vathaire F, Drozdovitch V, Brindel P, Rachedi F, Boissin JL, Sebbag J, Shan L, Bost-Bezeaud F, Petitdidier P, Paoaafaite J, Teuri J, Iltis J, Bouville A, Cardis E, Hill C, Doyon F., « Thyroid cancer following nuclear tests in French Polynesia », Br J Cancer., vol. 103, no 7, , p. 1115-21. (PMID 20808313, DOI 10.1038/sj.bjc.6605862, lire en ligne)
- Étude 2003 sur Tchernobyl et le cancer de la thyroïde sur doctissimo
- http://www.invs.sante.fr/fr/Publications-et-outils/Rapports-et-syntheses/Maladies-chroniques-et-traumatismes/2011/Evolution-de-l-incidence-du-cancer-de-la-thyroide-en-France-metropolitaine.-Bilan-sur-25-ans Page 3, « Une évaluation des conséquences sanitaires de l'accident de Tchernobyl en France a été publiée en 2001. Ce travail concluait que les connaissances scientifiques actuelles ne permettent pas d’exclure la possibilité d’un faible excès de cancers de la thyroïde en France lié à cet accident. [...] Cependant, les estimations [...] utilisant les niveaux d’exposition aux retombées de cet accident (cartographie de l'Institut de radioprotection et sûreté nucléaire (IRSN) ont permis d’exclure un impact important des retombées de Tchernobyl en France. »
- Communiqué CEA (2004) et article Diagnostic différentiel des tumeurs de la thyroïde grâce aux puces à ADN. Clinical Cancer Research (2004) 10 : 6586-6597
- (en) Smith-Bindman R, Lebda P, Feldstein VA. et al. « Risk of thyroid cancer based on thyroid ultrasound imaging characteristics, results of a population-based study » JAMA Intern Med. 2013;173:1788-95.
- (en) Cooper DS, Doherty GM, Haugen BR. et al., « Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer », Thyroid, no 19, , p. 1167-1214 (lire en ligne)
- (en) Pacini F, Schlumberger M, Dralle H. et al., « European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium », Eur J Endocrinol., no 154, , p. 787-803 (lire en ligne)
- (en) Udelsman R, Shaha AR, « Is total thyroidectomy the best possible surgical management for well-differentiated thyroid cancer? » Lancet Oncol. 2005;6:529-31.
- (en) Bilimoria KY, Bentrem DJ, Ko CY et al., « Extent of surgery affects survival for papillary thyroid cancer », Ann Surg., no 246, , p. 375-381 (résumé)
- (en) McLeod DS, Sawka AM, Cooper DS, « Controversies in primary treatment of low-risk papillary thyroid cancer », Lancet, no 381, , p. 1046-1057 (PMID 23668555, résumé)
- (en) Durante C, Haddy N, Baudin E et al., « Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy », J Clin Endocrinol Metab, no 91, , p. 2892-2899 (PMID 16684830, lire en ligne)
- (en) Haymart MR, Repplinger DJ, Leverson GE et al., « Higher serum thyroid stimulating hormone level in thyroid nodule patients is associated with greater risks of differentiated thyroid cancer and advanced tumor stage », J Clin Endocrinol Metab, no 93, , p. 809-14. (PMID 18160464, lire en ligne)
- (en) Hovens GC, Stokkel MP, Kievit J et al., « Associations of serum thyrotropin concentrations with recurrence and death in differentiated thyroid cancer », J Clin Endocrinol Metab, no 92, , p. 2610-2615 (PMID 17426094, lire en ligne)
- cancer.org > Thyroid Cancer By the American Cancer Society. In turn citing: AJCC Cancer Staging Manual (7th ed).
- (en) H J Biersack, F Grünwald, Thyroid cancer, Berlin, Springer, , 363 p. (ISBN 3-540-22309-6, OCLC 62708352, lire en ligne) (Note : il est affirmé, également que les 14 % à 10 ans de survie pour le cancer anaplasique de la thyroïde ont été surestimés
- (en) eMedicine > Thyroid, Papillary Carcinoma Author: Luigi Santacroce. Coauthors: Silvia Gagliardi and Andrew Scott Kennedy. Updated: Sep 28, 2010
- By 100% minus cause-specific mortality of 17% at 5 yr, as given by DOI:10.1210/jc.2005-0044
- (en) National Cancer Institute > Medullary Thyroid Cancer Last Modified: 12/22/2010
- Furio Pacini, Martin Schlumberger, Henning Dralle, Rossella Elisei, Johannes W.A.Smit, Wilmar Wiersinga et l'European Thyroid Cancer Taskforce, « Consensus européen pour la prise en charge des patients avec cancer différencié de la thyroïde de souche folliculaire », European Journal of Endocrinology, no 153, , p. 651-659 (lire en ligne [PDF])
- (en) Handkiewicz-Junak D, Roskosz J, Hasse-Lazar K et al., « 13-cis-Retinoic acid re-differentiation therapy and recombinant human thyrotropin-aided radioiodine treatment of non-functional metastatic thyroid cancer: a single-center, 53-patient phase 2 study », Thyroid Res, no 2, , p. 8-8 (PMID 19646277, lire en ligne)
- (en) Ho AL, Grewal RK, Leboeuf R. et al., « Selumetinib-enhanced radioiodine uptake in advanced thyroid cancer », N Engl J Med., no 368, , p. 623-632 (résumé)
- (es) « Cordobesas descubren cómo los tumores de tiroides se vuelven más agresivos », sur La Voz (consulté le )
- (en) Laura Fozzatti, Vanina Alejandra Alamino, Sunmi Park et Lucila Giusiano, « Interplay of fibroblasts with anaplastic tumor cells promotes follicular thyroid cancer progression », Scientific Reports, vol. 9, no 1, , p. 8028 (ISSN 2045-2322, DOI 10.1038/s41598-019-44361-6, lire en ligne, consulté le )
Voir aussi
Articles connexes
Liens externes
- Schlumberger M. "Cancer papillaire et folliculaire de la thyroïde" Annales d'Endocrinologie, sur le site orpha.net
- (en) Thyroid Cancer Clinical Trials Page (American Thyroid Association)
- (en) Association de survivants au cancer de la thyroïde (Thyroid Cancer Survivors' Association)
- Portail de la médecine