Bis(triméthylsilyl)amine
La bis(triméthylsilyl)amine ou hexaméthyldisilazane (HMDS) est un composé organique silylé de formule semi-développée (CH3)3Si-NH-Si(CH3)3 qui consiste en une molécule d'ammoniac substituée par deux groupes fonctionnels triméthylsilyle. C'est un liquide clair et incolore avec une odeur d'ammoniac qui s'hydrolyse lentement avec l'humidité de l'air.
| Bis(triméthylsilyl)amine | ||
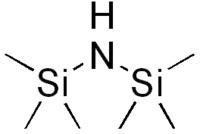
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1,1,1,3,3,3-hexaméthyldisilazane | |
| Synonymes |
HMDS, hexaméthyldisilazane |
|
| No CAS | ||
| No ECHA | 100.012.425 | |
| No CE | 213-668-5 | |
| PubChem | 13838 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore et clair[1] | |
| Propriétés chimiques | ||
| Formule | C6H19NSi2 [Isomères] |
|
| Masse molaire[2] | 161,3928 ± 0,0069 g/mol C 44,65 %, H 11,87 %, N 8,68 %, Si 34,8 %, |
|
| pKa | 8.5[3] | |
| Propriétés physiques | ||
| T° fusion | −70 °C[3] −82 °C[1] |
|
| T° ébullition | 125 °C[3] 127 °C[1] |
|
| Masse volumique | 0,78 g·cm-3[1] | |
| T° d'auto-inflammation | 380 °C[3] | |
| Point d’éclair | 11 °C[3] | |
| Pression de vapeur saturante | 20 mmHg à 20 °C[3] 20 hPa à 20 °C[1] |
|
| Propriétés optiques | ||
| Indice de réfraction | 1,4069–1,4089[4] | |
| Précautions | ||
| SGH[1] | ||
   |
||
| NFPA 704 | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Les bis(triméthylsilyl)amidures résultent de la déprotonation de l'amine et sont utilisés comme bases fortes non nucléophiles car trop encombrés. Les plus couramment utilisés sont :
- le bis(triméthylsilyl)amidure de lithium (LiHMDS) ;
- le bis(triméthylsilyl)amidure de sodium (NaHMDS) ;
- le bis(triméthylsilyl)amidure de potassium (KHMDS).
Synthèse
L'hexaméthyldisilazane peut être obtenu via une réaction du chlorure de triméthylsilyle avec l'ammoniac[5] :
Propriétés
L'hexaméthyldisilazane est un liquide incolore à jaune avec une odeur d'amine et qui est hautement inflammable. Ce composé a un point d'éclair inférieur à 15 °C. La plage d'explosion est comprise entre 0,8 % vol. comme limite inférieure d'explosivité (LIE) et 25,9 % vol. comme limite supérieure d'explosivité (UEL)[1]. Par hydrolyse lente avec l'humidité, l'hexaméthyldisilazane forme de l'hexaméthyldisiloxane et de l'ammoniac[6]. Lors d'un contact avec l'eau, le composé est d'abord hydrolysé dans une réaction exothermique violente et forme de l'ammoniac et du triméthylsilanol, qui est instable et produit par élimination de l'eau de l'hexaméthyldisiloxane (bis(triméthylsilyl) éther). La chaleur de l'hydrolyse est −144,4 kJ/mol[7].
Utilisations
Un des usages de la bis(triméthylsilyl)amine est celui de réactif dans les réactions de condensation d'hétérocycles comme dans la synthèse par micro-onde d'un dérivé de la xanthine[8]:
En photolithographie, le HMDS est souvent utilisé comme promoteur d'adhérence pour les résines photosensibles. De meilleurs résultats sont obtenus en appliquant du HMDS en phase gazeuse sur les substrats[9].
En microscopie électronique, le HMDS peut être utilisé comme une alternative au séchage supercritique pendant la préparation des échantillons[10].
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bis(trimethylsilyl)amine » (voir la liste des auteurs).
- Entrée « 1,1,1,3,3,3-Hexamethyldisilazane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10 janvier 2017 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- MSDS
- Fiche Hexamethyldisilazane chez ChemBlink.com, consulté le 25 février 2011.
- Georg Brauer, Handbuch der Präparativen Anorganischen Chemie, Enke, Stuttgart, 1975, chapite I, p. 711. (ISBN 3-432-02328-6).
- (de) Entrée 1,1,1,3,3,3-Hexamethyldisilazan sur Römpp Online. Georg Thieme Verlag, consultée le 14 juin 2014.
- A. E.Beezer, C. T. Morti., DOI:10.1039/J19660000514 .
- Microwave-assisted ring closure reactions: synthesis of 8-substituted xanthine derivatives and related pyrimido- and diazepinopurinediones, Burbiel JC, Hockemeyer J, Müller CE; Beilstein J. Org. Chem., 2006, vol. 2, p. 20. DOI:10.1186/1860-5397-2-20
- CNF - Photolithography Resist Processes and Capabilities, Cornell NanoScale Science & Technology Facility.
- Comparison of hexamethyldisilazane (HMDS), Peldri II, and critical-point drying methods for scanning electron microscopy of biological specimens, Bray DF, Bagu J, Koegler P; Microsc. Res. Tech., 1993, vol. 26(6), p. 489–95. DOI:10.1002/jemt.1070260603.
- Portail de la chimie

