Benzènehexol
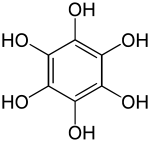
Le benzènehexol ou hexahydroxybenzène est un composé aromatique de formule C6H6O6 ou C6(OH)6. Il consiste en un noyau benzénique entièrement substitué par des groupes hydroxyle, c'est le sextuple alcool du benzène[3],[5]. Ce composé est aussi appelé hexaphénol[6], mais ce nom a aussi été utilisé pour d'autres substances[7].
| Benzènehexol | |
| |
| Identification | |
|---|---|
| Nom UICPA | benzène-1,2,3,4,5,6-hexol |
| Synonymes |
hexahydroxybenzène |
| No CAS | |
| No ECHA | 100.204.877 |
| PubChem | 69102 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C6H6O6 [Isomères] |
| Masse molaire[1] | 174,1082 ± 0,007 g/mol C 41,39 %, H 3,47 %, O 55,14 %, |
| Propriétés physiques | |
| T° fusion | 200 °C [2] 310 °C[3] |
| Précautions | |
| SGH[4] | |
 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Le benzènehexol est un solide cristallin soluble dans l'eau chaude[6] et qui possède un point de fusion supérieur à 310 °C[3]. Il peut être préparé de l'inositol (cyclohexanehexol). Son oxydation produit du tétrahydroxy-1,4-benzoquinone (THBQ) puis de l'acide rhodizonique et du dodécahydroxycyclohexane[8]. Inversement, le benzènehexol peut être obtenu par réduction du sel de sodium de THBQ avec un mélange SnCl2 et HCl[9].
Le benzènehexol est un composé de départ pour les cristaux liquides discotiques[9]. Il forme aussi un adduit de ratio 2:1 avec la 2,2'-bipyridine[10].
Benzènehexolate
Comme la plupart des phénols, le benzènehexol peut perdre six ions H+ de ses groupes hydroxyle formant l'hexanion C6O66–. le sel de potassium de cet anion est un des composants du « potassium carbonyl » de Liebig, issu de la réaction du monoxyde de carbone, CO avec du potassium, K. L'hexanion peut être produit de la trimérisation d'anions éthynediolates, C2O22– en chauffant de l'éthynediolate de potassium, K2C2O2[11]. La nature exacte de K6C6O6 a été clarifiée par B. Nietzki et T. Benckiser en 1885 qui trouvèrent que son hydrolyse produit du benzènehexol[12],[13],[14].
Le sel benzènehexolate de lithium, Li6C6O6 a été considéré pour des applications dans les piles électriques[15].
Ester
le benzène hexol forme des esters comme l'hexaacétate, C6O6(-O(CO)CH3)6 (p.f. 220 °C) et des éthers comme l'hexa-tert-butoxybenzène, C6O6(-OC(CH3)3)6 (p.f. 223 °C)[11].
Il forme aussi des esters d'acide oxalique ou d'acide carbonique qui sont de fait des oxydes de carbone comme le trisoxalate d'hexahydroxybenzène ou le triscarbonate d'hexahydroxybenzène.
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Benzenehexol » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) J. Rosinski et A. Lecinski, « Further studies of heterogeneous nucleation of ice at the liquid-liquid interface », The Journal of Physical Chemistry, vol. 85, no 20, , p. 2993-2997 (DOI 10.1021/j150620a029)
- A. J. Fatiadi and W. F. Sager, Hexahydroxybenzene (Benzenehexol), Organic Syntheses, 1973, coll. col. 5, p. 595
- (de) Hexahydroxybenzol chez TCI Europe
- Gerd Leston, (Polyhydroxy)benzenes, Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, 1996. DOI:10.1002/0471238961.1615122512051920.a01.
- J.I.G. Codagan, John Buckingham, Finlay J. MacDonald, P. H. Rhodes, Dictionary of organic compounds, CRC Press, 1996. (ISBN 0-412-54090-8), (ISBN 978-0-412-54090-5).
- (en) HEXAPHENOL Basic information. Chemical Book.
- (en) Alexander J. Fatiadi, Horace S. Isbell et William F. Sager, « Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol) », Journal of Research of the National Bureau of Standards A: Physics and Chemistry, vol. 67A, no 2, , p. 153–162 (lire en ligne)
- Sandeep Kumar, Self-organization of disc-like molecules: chemical aspects, Chem. Soc. Rev., 2006, vol. 35, pp. 83–109. DOI:10.1039/b506619k.
- John A. Cowan, Judith A. K. Howard, Michael A. Leech, Horst Puschmann and Ian D. Williams, Hexahydroxybenzene—2,2'-bipyridine (1/2), Acta Crystallographica Section C, 2001, vol. C57, pp. 1194–1195.
- Fèlix Serratosa, Acetylene Diethers: A Logical Entry to Oxocarbons, Acc. Chem. Res., 1983, vol. 16, pp. 170-176. DOI:10.1021/ar00089a004.
- B. Nietzki and T. Benckiser, Berichte Chemie, 1885, vol. 18, p. 1834.
- Ludwig Mond, On metallic carbonyls, Proceedings of the Royal Institution, 1892, vol. 13, pp. 668-680. Reprint in The Development of Chemistry, 1789-1914: Selected essays édité par D. Knight,1998. (ISBN 0-415-17912-2), version en ligne.
- Werner Büchner, E. Weiss, Zur Kenntnis der sogenannten «Alkalicarbonyle» IV[1] Über die Reaktion von geschmolzenem Kalium mit Kohlenmonoxid", Helvetica Chimica Acta, 1964, vol. 47(6), pp. 1415–1423. DOI:10.1002/hlca.19640470604.
- Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Grey, Franck Dolhem, Jean-Marie Tarascon, and Philippe Poizot, Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery, J. Am. Chem. Soc., 2009, vol. 131(25), pp. 8984–8988. DOI:10.1021/ja9024897.