Pile électrique
Une pile électrique[alpha 1], dite familièrement pile[1], est un dispositif électrochimique qui produit de l'électricité en convertissant l'énergie chimique en énergie électrique grâce à une réaction chimique d'oxydoréduction.
Pour les articles homonymes, voir pile.
Vocabulaire : pile, accumulateur, batterie
Pile et « pile rechargeable »

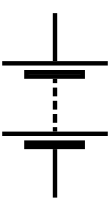
À l'origine, le terme « pile » désignait un dispositif inventé par le savant italien Alessandro Volta, composé d'un empilement de rondelles de deux métaux différents, séparés par des feutres imprégnés d'un électrolyte[1].
Le mot « pile » désigne aujourd'hui tout élément monobloc, dont la décharge est irréversible[2]. En effet, une fois que le potentiel des électrodes a été égalisé, il n'est plus possible de restaurer le potentiel initial.
Par extension, on appelle « pile rechargeable » un petit accumulateur électrique rechargeable de dimensions identiques à une pile, dont la tension est généralement inférieure à celle d'une pile alcaline de même taille.
Batterie
Le terme « batterie » désigne une association en série ou en parallèle de piles ou accumulateurs[3] afin que l'ensemble atteigne certaines caractéristiques nominales, telles que la tension, le courant maximum admissible ou la capacité.
Si les éléments montés les uns avec les autres sont des accumulateurs, ils forment une batterie d'accumulateurs[2],[4]. Dans le cas d'une association de piles, l'assemblage, non rechargeable, est nommé batterie primaire.
Le terme de « batterie » utilisé dans l'industrie automobile désigne donc plus exactement une batterie d'accumulateurs, celle-ci étant rechargeable.
Autres

Le terme « pile » apparaît dans d'autres dénominations qui ne partagent pas le même principe de fonctionnement. Ainsi, la pile à combustible, bien que fonctionnant également par réaction d'oxydoréduction, n'est pas constituée d'empilement de métaux.
Principe de fonctionnement
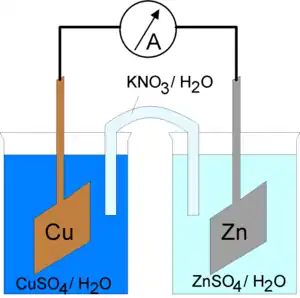
Le boîtier d'une pile abrite une réaction chimique entre deux substances dont l’une peut céder facilement des électrons (matériau réducteur), et l’autre qui les absorbe (matériau oxydant). Chacune de ces réactions chimiques est dite « demi-réaction ». Lorsqu'elles sont proprement combinées, elles forment une réaction d'oxydoréduction. Chaque demi-réaction survient dans une solution où se produit un échange d'électrons. Ce sont ces électrons qui sont échangés entre les deux substances. Pour assurer l'équilibre des charges électriques, il faut relier les deux solutions à l'aide d'un pont salin, système qui permet le transport de certains ions tout en interdisant la circulation du solvant.
Chaque élément du couple oxydant/réducteur est relié à une électrode. Ces électrodes, lorsqu'elles sont reliées à un circuit consommateur d'électricité, provoquent la circulation d'un courant électrique ; la réaction chimique provoque une circulation de charges (électrons, ions). Une pile fournit du courant continu. La borne (-) d'une pile correspond à l'anode où se produit la réaction d'oxydation qui va fournir les électrons. La borne (+) d'une pile correspond à la cathode où se produit la réaction de réduction qui va consommer les électrons.
Ce système est utilisé pour les piles électriques et les batteries d'accumulateurs, avec divers couples électrochimiques. Une pile électrique peut contenir plusieurs de ces couples montés en série, ce qui permet d'ajuster la tension disponible, aux bornes de la pile, à la valeur désirée.
Il est possible de réaliser une pile artisanale, par exemple en piquant dans un citron un trombone déplié ou un clou (en acier galvanisé, recouvert donc de zinc) et un fil électrique dénudé (en cuivre) reliés à une diode électroluminescente bien choisie[5]. À l'anode, le zinc cède ses électrons, et à la cathode l'ion H+ du jus acide capte les électrons et se dégage sous forme d'hydrogène H2[6]. On trouve dans le commerce des gadgets qui utilisent ce même principe : par exemple de petites horloges à quartz qui sont alimentées par une pomme de terre (même principe à l'anode, alors qu'à la cathode l'eau se réduit en ions OH- et en hydrogène)[7].
Histoire
Il existe des objets archéologiques, comme ceux trouvés en 1936, ressemblant à des piles. C'est le cas de la pile électrique de Bagdad, datant du IIIe siècle av. J.-C., bien que sa fonction de pile soit controversée [8]. Elles auraient fonctionné aux jus de fruits voire au sulfate de cuivre, des expérimentations sur des reconstitutions modernes ont validé la faisabilité des deux modèles. Il n'existe aucun lien historique entre ces objets et le développement des piles contemporaines d'autant que l'usage de celles-ci serait le placage de métaux précieux ce qui expliquerait son usage mineur, confidentiel, voire associé à un usage de faussaire (voir Archimède et la couronne du roi Hiéron)[9].
En 1786, Luigi Galvani observe que les muscles d'une cuisse de grenouille se contractent lorsqu'elle est mise en contact avec des métaux, de la même manière que lorsqu'on la branche sur une machine électrostatique. Il découvre que la réaction est plus forte quand il utilise un instrument composé de deux métaux différents[10].
En opposition avec les travaux de Galvani (électricité d'origine animale), Alessandro Volta invente la première pile à colonne le [11] ; ces premiers systèmes étaient constitués d'un « empilement » (d'où le nom de l'invention) de disques de deux métaux différents séparés par des disques de feutre, imbibés d'acide. La pression de la colonne sur les disques du bas provoque un assèchement des cylindres de feutre qui finissent par ne plus remplir leur office. Volta invente donc rapidement la pile à couronne, constituée d'empilements plus petits montés en série[12].
Quelques mois après l'invention de Volta, deux chimistes britanniques, William Nicholson (1753-1815) et Anthony Carlisle (1768-1840), utilisent la pile de Galvani pour réaliser la première électrolyse artificielle (électrolyse de l'eau) le [13].
Dès 1802, William Cruickshank crée la pile à auge en disposant verticalement les lames de zinc et de cuivre dans un bac à parois isolantes rempli d'eau acidulée. Elle est beaucoup plus simple à produire que la pile de Volta[12].
- Différents types de pile Volta

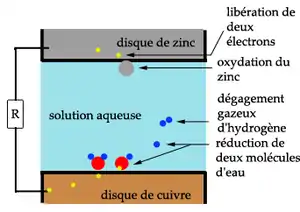 Schéma de fonctionnement de la pile Volta.
Schéma de fonctionnement de la pile Volta. Schéma de la pile Volta.
Schéma de la pile Volta.
Piles polarisables
Entre 1813 et 1815, William Hyde Wollaston développe la pile Wollaston dans laquelle l'électrode de cuivre entoure l'électrode de zinc. Cela permet de doubler la surface de l'électrode et de prolonger le fonctionnement de la pile. Ces premières piles souffrent en effet d'un défaut de fonctionnement : la polarisation.
La réaction d'oxydo-réduction provoque une accumulation de sous-produits qui perturbe le fonctionnement de la pile. Dans ces piles zinc-cuivre, c'est la réduction de l'acide de l'électrolyte qui produit un dégagement de bulles de dihydrogène sur le cuivre qui empêche le passage du courant. Au bout d'un certain temps, il est donc nécessaire de nettoyer la pile de ces dépôts pour qu'elle continue de fonctionner.
En 1813, Napoléon fournit à l'École polytechnique une pile voltaïque de 600 couples cuivre/zinc, occupant 54 m2 de surface. Humphry Davy fait construire une pile Cruickshank constituée de 200 auges et de 2 000 couples[Quoi ?] à l'institut Royal de Londres. Avec ces piles monumentales il était possible d'obtenir des intensités de 10 ampères, soit des puissances de l'ordre de la dizaine de kW.
Piles impolarisables
Dans les piles impolarisables, les produits de la réaction d'oxydo-réduction utilisée n'altèrent pas les propriétés électrochimiques de l'ensemble.
En 1829, Antoine Becquerel crée la première pile à deux liquides séparés en enfermant la plaque de zinc en solution acide dans un gros intestin de bœuf, qui la sépare de l'électrode de cuivre placée dans un bain de sulfate de cuivre. La génération d'hydrogène est remplacée par une accumulation de cuivre sur les parois de la cathode.
Le principe est amélioré en 1836 par John Frederic Daniell qui remplace l'intestin de bœuf par un vase en terre poreuse. La pile Daniell est la première à offrir une source durable d'énergie. Le principe de la pile Daniell sera amélioré : plusieurs améliorations technologiques suivront, comme les piles Callaud.
Johann Christian Poggendorff invente en 1842 la pile à bichromate : elle dégage de l'oxygène qui se recombine avec l’hydrogène responsable de la polarisation. Créée en 1850, la pile Grenet est une pile à un seul liquide, avec des électrodes en charbon et en zinc amalgamé (plongé dans le mercure) dans un électrolyte d'acide sulfurique et de bichromate de potassium. Quand la pile n'était pas utilisée, il était nécessaire de retirer l'électrode en zinc de la solution pour la préserver. Diverses améliorations (pile Trouvé, pile Chardin, pile Voisin et Dronier…) vont suivre pour isoler cette électrode.
Ces piles bouteilles seront utilisées jusqu'au début du XXe siècle : la puissance et la tension élevée des piles au bichromate ont été longtemps appréciées au laboratoire. Elles ont été peu utilisées comme pile domestique à cause de la toxicité des bichromates et des problèmes d'entretien de l'électrode.
Piles à dépolarisation


Les piles à dépolarisation utilisent un réducteur pour éliminer les produits de réaction qui se forment à la cathode.
La première pile à dépolarisation est inventée en 1838 par William Robert Grove. Il remplace le cuivre par du platine et utilise de l'acide nitrique (nommé acide azotique à cette époque). Il obtient une pile puissante mais chère car le platine est un métal rare. En 1843, Robert Wilhelm Bunsen remplace le platine par du charbon ce qui réduit notablement les coûts (voir Pile Bunsen) mais la dépolarisation nitrique entraîne un dégagement de vapeurs toxiques qui rend l'emploi de ces piles malcommode.
En 1867, Georges Leclanché crée la première pile à dépolarisant solide : elle contient du dioxyde de manganèse. La pile Leclanché est moins puissante que la pile bouteille mais ne nécessite aucun entretien (elle « ne s'use que si l'on s'en sert » comme dira la publicité de la pile Wonder). En 1888, Carl Gassner invente la pile sèche en gélifiant la solution de chlorure d'ammonium avec de l'agar-agar. Avec quelques améliorations, cette pile sèche est toujours utilisée au XXIe siècle.
Pendant la Seconde Guerre mondiale, Samuel Ruben et Philip Mallory créent la pile au mercure.
En 1959, la première pile alcaline grand public est conçue par Lewis Urry, Karl Kordesch et Paul A. Marsal pour Union Carbide.
En 1970, les premières piles au lithium, permettant de remplacer le zinc par un métal plus réducteur, sont mises au point. Elles sont commercialisées en 1977.
Des piles ont été utilisées comme références pour définir une norme de tension avant d'être détrônées par une mesure basée sur l'effet Josephson : la pile Daniell, puis la pile Clark inventée en 1872 par Josiah Latimer Clark a été employée jusqu'en 1905, puis elle a été remplacée par la cellule de Weston jusqu'en 1972.
Piles de concentration
Il existe aussi ce qu'on appelle des piles de concentration qui sont des dispositifs électrochimiques comme les piles (deux solutions et un pont salin) qui tirent leur énergie de la différence de concentration d'un soluté d'une solution à l'autre. Les solutions et les anodes sont toutes de même type. C'est une méthode simple pour fabriquer de l'électricité. Ce modèle de pile intervient surtout dans l'industrie métallurgique au niveau de la galvanisation et de l'étude de la corrosion.
Classification
Par technologie
Il existe cinq technologies de piles grand public :
- pile alcaline : ( ⊝ Zn | Zn(OH)42− | K+ + OH− | MnO(OH) | MnO2 | C ⊕ ) ;
- pile saline : ( ⊝ Zn | Zn2+ | NH4+ + Cl− | MnO(OH) | MnO2 | C ⊕ ) ;
- pile au lithium ( ⊝ Li(s) | LiCl(SOCl2) | MnO2 (s), Mn2O3 (s) | Fe(s) ⊕ ) ;
- pile à l'oxyde d'argent (certaines piles boutons pour montres)
- pile zinc-air (utilisée notamment dans les prothèses auditives) (⊝ Zn | ZnO || Ag2O | Ag | C ⊕).
Depuis décembre 1998, les piles au mercure sont interdites en Europe (directive 98/101/CE[14]) et aux États-Unis en raison de la toxicité et de l'impact environnemental du mercure.
Par format
Les formats de piles sont couramment désignés par un code (AA, LR12, CR2032…) normalisé par la Commission électrotechnique internationale (CEI) et par l'American National Standards Institute (ANSI). Bien que la norme CEI soit devenue un standard, un certain nombre d'appellations propres aux fabricants de piles subsiste.
Par force électromotrice ou tension nominale

La force électromotrice (f.e.m.) est la tension qui existe aux bornes de la pile en circuit ouvert. Pour la mesurer on peut utiliser un multimètre à forte résistance interne, tel que par exemple un multimètre numérique ou un « testeur de pile ».
Lorsque la pile se décharge (que ce soit du fait de son utilisation ou à cause du temps) la f.e.m ne diminue que légèrement[alpha 3], ce qui peut laisser croire que la pile est toujours utilisable. Par contre, la résistance interne de la pile augmente, donc l'énergie qu'elle peut délivrer diminue, ainsi que la tension à ses bornes, au fur et à mesure de la décharge de la pile. Il est donc préférable pour tester une pile de mesurer sa tension en utilisation normale (ou avec un testeur consommant du courant pour simuler cette utilisation).
La tension nominale (ou f.e.m. nominale), c'est-à-dire celle qui est inscrite sur la pile elle-même ou son emballage, correspond en fait à la f.e.m. de la pile à l'état neuf.
Les piles salines et alcalines ont une tension nominale de 1,5 V environ, tandis que celle des piles au lithium est de 3,6 V environ.
Les piles de tensions nominales plus élevées sont constituées d'une association en série de cellules de 1,5 V (3 éléments en série, dans une pile 3LR12 de 4,5 V ; 6 dans une pile 6LF22 de 9 V).
Par capacité
Suivant le mode de fabrication d'une pile, sa capacité (voir section ci-dessous) peut-être très variable.
La mention de la capacité d'une pile n'est pas obligatoire sur les emballages et est très rarement mentionnée.
Capacité et décharge des piles
Capacité électrique ou capacité énergétique

- capacité électrique Q = 24 000 mAh ;
- capacité énergétique E = 88,8 Wh.
On utilise usuellement deux sortes de « capacité » pour une pile (ou pour une batterie), sans toujours se rendre compte de la différence entre les deux, ni préciser de laquelle on parle[alpha 4] :
- La capacité électrique
- de symbole Q d'une pile est la quantité maximale de charge électrique qu'elle peut fournir au cours de son utilisation (décharge). Elle correspond au produit du courant qui sera fourni par le nombre d'heures d'utilisation. Dans le SI, elle s'exprime en coulombs (C), mais on utilise couramment l'ampère-heure (1 A h = 3 600 C) ou le milliampère-heure (1 mA h = 3,6 C).
- La capacité énergétique
- de symbole E est la quantité d'énergie qu'elle peut fournir lors de sa décharge. Elle correspond au produit de la puissance fournie par le nombre d'heures d'utilisation. Elle s'exprime couramment en watt-heure (Wh), ou en milliwatt-heure (mWh).
Il existe une relation simple entre ces deux capacités : la capacité énergétique est le produit de la capacité électrique par la tension nominale U de la pile :
Il est important de ne pas confondre ces deux types de capacités. Mettre deux piles en série n'augmente pas la capacité électrique, alors que la capacité énergétique est multipliée par deux.
Sur l'image ci-contre on peut voir indiquées, sur un appareil de type power bank du commerce, les deux types de capacités[alpha 5].

Une analogie hydraulique : la capacité du réservoir d'un barrage hydroélectrique est la quantité d'eau qu'il contient. Elle ne doit pas être confondue avec la capacité énergétique de ce réservoir qui est la quantité d'énergie qu'il est capable de fournir au réseau électrique. Cette capacité énergétique dépend de l'altitude (moyenne) du réservoir par rapport aux turbines de l'usine hydroélectrique. Cette altitude est l'équivalent de la tension dans le cas d'une batterie (ou d'une pile).
Mesure de la capacité électrique
La capacité électrique Q dépend de la quantité d'électrolyte et d'électrode, mais aussi des conditions de décharge (intensité du courant de décharge, tension de coupure de l'appareil, température d'utilisation)[15].
Si l'intensité de décharge I est constante, la capacité Q est proportionnelle à la durée de décharge Δt :
Si l'intensité i varie, alors :
La capacité électrique théorique d'une pile (ou d'une batterie), telle que définie par les fabricants, est mesurée sur un échantillon du modèle en effectuant une décharge à 20 °C sur un équipement normalisé. L'intensité de décharge est choisie pour que celle-ci dure environ 20 h. Il ne reste plus qu'à faire le produit de l'intensité par le temps effectif de décharge.
- Par exemple :si une pile de 1,5 V délivre 0,5 A pendant 21 h à la température normale d'une pièce, sa capacité électrique est de 0,5 x 21 = 10,5 Ah, et sa capacité énergétique est de 10,5 x 1,5 = 15,75 Wh
En fait ce n'est pas aussi simple, car :
- il est difficile d'apprécier la fin de la décharge (la tension mesurée devra être un certain pourcentage de la tension nominale - quel pourcentage choisir ? 80% ? 90% ?..)
- la capacité ainsi mesurée dépend du courant de décharge (voir loi de Peukert ci-dessous)
- on constate que des mesures répétées sur un même modèle dans les mêmes conditions donnent des résultats qui peuvent être très différents.[réf. nécessaire]
Loi de Peukert
La loi de Peukert est une relation donnant le temps de décharge en fonction de la capacité électrique théorique d'une pile (ou d'une batterie) et du courant de décharge :
où :
- est la capacité électrique théorique (en fait celle mesurée à 1 ampère(A)) ;
- est le courant effectivement débité par la pile en ampères ;
- est le temps de décharge ;
- est une constante empirique de l'ordre de 1,3 pour les batteries au plomb, mais très voisine de 1 pour les batteries au lithium.
En pratique, une pile (ou une batterie) est plus efficace (tiendra plus longtemps) si elle est déchargée avec une basse intensité.
En outre, pour les basses puissances, il faut prendre en compte l'auto-décharge :
pour une pile qui a une auto-décharge relativement élevée, l'auto-décharge peut consommer la majorité de la capacité de la batterie[réf. nécessaire]. Précisons que toutes les piles se déchargent au cours du temps, même si elles ne sont pas utilisées[réf. nécessaire]. Il existe des technologies de piles activables qui permettent de contrôler le démarrage de la réaction. Elles sont par exemple utilisées dans les éléments de sécurité (coussin gonflable, balise de détresse de bateau, etc.) ou dans certaines applications militaires. C'est aussi le cas des piles boutons zinc-air, il faut enlever la languette qui ferme l'élément avant de le mettre en service.
Assemblage en série
Beaucoup de piles sont utilisées par groupe de 2 à 6 éléments en série. La performance d'un assemblage de piles branchées en série est celle de son élément le plus faible. Par exemple une pile de 4,5 V est une assemblage dans le même boîtier de 3 piles de 1,5 V montées en série.
Utilisation des piles
Consommation
En 2004, 875 millions de piles ont été vendues en France (alcalines 75 %, salines 22 %, rechargeables 2 %)[16], 100 millions en Belgique en l'an 2000.
Fabricants
Parmi les fabricants de piles, on peut citer Duracell, Energizer, Sony, Rayovac, Varta, Philips, Panasonic, Saft, Kodak, Maxell, etc.
Efficacité énergétique
En moyenne, les piles électriques sont jetées alors qu'elles possèdent encore un tiers d'énergie utilisable[17], et 1/10 seraient encore presque neuves. En effet, les appareils électroniques (appareil photo numérique, lecteur MP3, etc.) ont besoin d'une tension minimale pour fonctionner. Or, la tension de l'ensemble baisse au cours de la décharge, mais à une vitesse différente selon l'élément. Les piles possédant encore une certaine capacité peuvent alors encore être utilisées pour alimenter des appareils moins exigeants (réveil, jouet, lampe de poche, télécommande, etc.).
Sécurité
Le principal danger direct pour l'homme est, de loin, l'ingestion par les jeunes enfants de piles bouton de taille moyenne (> 16 mm). Le risque majeur est celui d'un enclavement de la pile dans l’œsophage : l'électrolyse de l'eau avec la formation d'ions OH- à l'anode constitue le mécanisme lésionnel essentiel, d'autant plus grand que la pile est neuve et de tension élevée (3,6 V pour les piles au lithium). Le risque lié à l'éventuelle libération des constituants d'une pile bouton est faible du fait de leur petite quantité dans ces petites piles.
Réutilisation des piles électriques
D'un point de vue électro-chimique, les couples redox des piles alcalines zinc-manganèse (à l'anode et à la cathode) sont partiellement réversibles[18]. Les réactions chimiques inverses sont donc possibles. La chute de tension de la pile, qui se produit naturellement lors de la décharge, peut être inversée par l'injection d'un courant, qui va favoriser la réaction inverse. Ce qui explique que les piles alcalines peuvent être réutilisées jusqu'à plusieurs dizaines de fois avec des circuits électroniques adaptés[19],[20].
Les fabricants de piles, qui n'ont pas conçu les piles alcalines pour qu'elles soient réutilisables, recommandent de les recycler après un seul cycle de décharge. Ils mettent en avant des risques potentiels d'échauffement des piles, de fuite et d'explosion (due à la pression de dihydrogène gazeux libéré et à la mauvaise reconstitution de l'amalgame de zinc métallique)[21]. Néanmoins, des régénérateurs de piles alcalines existent et sont commercialisés.
Recyclage

Les piles contiennent des métaux (nickel, cadmium, mercure, plomb, fer, zinc ou lithium) dont certains sont précieux, et souvent toxiques et écotoxiques (nocifs pour l'environnement). L'enveloppe de la pile se décompose tôt ou tard, et libère les produits chimiques qu'elle contient.
Aucune pile commercialisée n'est biodégradable.
Europe
La directive européenne 2006/66/CE vise à réduire l’impact des piles et accumulateurs électriques sur l’environnement en favorisant leur recyclage et en limitant leur teneur en métaux écotoxiques.
En 2018, 48 % des piles commercialisées sont recyclées dans l'UE (post-Brexit) à 27 pays, et 52% ne sont pas recyclées[22].
Ce chiffre varie de 96% en Croatie à 30% en Estonie[22].
- La Suisse est la première au monde avec 70 % des piles collectées ; une écotaxe (comprise dans le prix de vente) en finance le recyclage[23].
- L'objectif européen, fixé par la directive 2006/66/CE, est de 25 % en 2012 et 45 % en 2016[24].
France
En France, les piles ne doivent pas être jetées dans une poubelle ordinaire, mais amenées à un point de collecte (supermarchés, déchetteries, points de ventes…) pour être recyclées. La législation française a transposé la directive européenne dans un décret en 2009[25]. Afin de réduire la teneur en certains métaux toxiques des piles (mercure notamment), le décret précise :
« Les piles et les accumulateurs mis sur le marché, y compris ceux qui sont intégrés dans des équipements électriques et électroniques […], ne contiennent pas plus de 0,0005 % de mercure en poids, à l'exception des piles bouton dont la teneur en mercure est inférieure à 2 % en poids, et pour les piles et accumulateurs portables pas plus de 0,002 % de cadmium en poids. »[26]
Afin de favoriser leur collecte et leur recyclage, il est indiqué :
« Les distributeurs de piles et accumulateurs portables reprennent gratuitement, et sans obligation d'achat de piles ou d'accumulateurs neufs, les piles et accumulateurs portables usagés du même type que ceux qu'ils commercialisent qui leur sont apportés par les utilisateurs. Ils informent les utilisateurs de la possibilité d'apporter des piles et accumulateurs portables usagés sur leurs points de vente. Les conteneurs mis à la disposition des utilisateurs à cet effet sont mis en évidence et facilement accessibles. »[26]
Le recyclage permet de récupérer des métaux réutilisables (fer, manganèse, zinc et mercure principalement) ; la valorisation matière représente 87,3 %, en masse, des piles traitées en 2011, la valorisation énergétique (incinération des plastiques et de certains résidus de broyage) 9,2 %, les 3,5 % restant étant éliminés sans valorisation[27].
Le taux de collecte est le rapport (en masse) entre la quantité de piles collectée et celle vendue. Depuis le début du recyclage, il est faible, et n'atteint jamais les objectifs.
- En France en 2011, 11 621 t de piles et d'accumulateurs (hors automobile et industrie) ont été collectées et recyclées selon l'Ademe, soit un taux de collecte de 36 %[27], et ce taux serait encore sous les 50 % (46 %) en 2016 selon Eucobat (la filière française fondée par Corepile et Screlec[28]).
- En 2018, selon Eurostat la France recycle 46% de ses piles[29].
Notes et références
Notes
- Simplification de pile d'éléments générateurs d’électricité.
- Inventée par Alessandro Volta qui lui a donné son nom.
- Sauf en fin de vie où elle devient nulle.
- Et sans se rendre compte non plus du risque de confusion avec la capacité d'un condensateur. La capacité d'un condensateur est en fait le quotient de Q par la tension U aux bornes de celui-ci. Son unité est le farad.
- Si la relation ci-dessus semble ne pas être vérifiée, c'est dû au fait que la tension nominale de la batterie n'est pas 5 V, mais de 3,7 V (batterie Lithium-ion) : On a bien alors 24 x 3,7 = 88,8. La tension de 5 V est en fait fournie en sortie de l'appareil par un circuit électronique intégré afin de charger des batteries d'autres appareils par un câble USB. La capacité électrique fournie par l'appareil sous cette tension de 5 V est donc en fait seulement de 88,8 / 5 = 17,6 Ah. Si le rendement de l'ensemble n'est que de 75 %, on ne pourra recharger avec cet appareil que 2 batteries de 6 Ah au lieu de 4 comme on aurait pu s'y attendre (puisque 24/6 = 4).
Références
- Définitions lexicographiques et étymologiques de « Pile » (sens c1) dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- « Une pile et une batterie, c’est la même chose », sur Connaissance des Énergies, 25 mar 2016 - 12:00 (consulté le )
- Serge Pélissier, Ali Sari et Pascal Venet, « Batteries électriques pour applications portables et embarquées - Fondamentaux », Techniques de l'Ingénieur, (lire en ligne)
- Définitions lexicographiques et étymologiques de « batterie » (sens 2. − P. anal., ÉLECTR.) dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- [PDF] Palais de la découverte, LA Pile au citron, IFIM23, 2006.
- « PILE AU CITRON - L'explication! » (consulté le )
- « 2x09 La pile patate » (consulté le )
- Christine Blondel, Bertrand Wolff et Marie-Hélène Wronecki, « La prétendue "pile" de Bagdad : une pile électrique il y a deux mille ans ? », sur ampere.cnrs.fr,
- Magazine, Monde Inconnu (Le), no 84, 06/1987, Technologies avancées dans les temps reculés, Michel Granger.
- Christine Blondel et Bertrand Wolff, « Galvani et "l'électricité animale" », sur ampere.cnrs.fr, (consulté le )
- Publication soumise le dans une lettre en français au président de la Royal Society, Joseph Banks.
- Paul Barbier, « Bonaparte et les savants, De la pile de Volta à la grande pile de l’École Polytechnique (1800-1812) », Bulletin d'histoire de l'électricité, vol. 34, no 1, , p. 5–28 (DOI 10.3406/helec.1999.1455, lire en ligne, consulté le )
- Christian Bailleux, « Histoire de l’électrolyse alcaline de l’eau de ses débuts à nos jours », Bulletin d'histoire de l'électricité, vol. 27, no 1, , p. 19–33 (DOI 10.3406/helec.1996.1310, lire en ligne, consulté le )
- Directive 98/101/CE de la Commission du 22 décembre 1998, sur eur-lex.europa.eu, consulté le 19 novembre 2018.
- Pierre Mayé, Générateurs électrochimiques : Piles, accumulateurs et piles à combustible, Dunod, , 208 p. (ISBN 978-2-10-055564-2, lire en ligne), p. 11.
- Qui sont les champions… des piles - Le journal du Management, 26 avril 2006.
- [PDF] La fausse mort des piles Sur le site energie-environnement.ch.
- (en)[PDF]Rechargeability of manganese dioxide in alkaline electrolyte, K. Kordesch et al., Electrochimica Acta Vol 26. no10 pp 1495-1504 - 1981.
- (en) [PDF] Recharging the unchargeable, Michael Slifkin, Electronics World p. 320 - 27 avril 1998.
- (en) Société Les Piles Wonder, « Caractéristiques générales des piles alcalines au bioxyde de manganèse »(Archive • Wikiwix • Archive.is • Google • Que faire ?), 1985 (à vérifier) (consulté le ), p. 3.
- Energizer, « Fiche technique de sécurité / pile Energizer / Eveready », (consulté le ).
- (en)Half of batteries sold are collected for recycling, europa.eu, consulté le 28 octobre 2020
- Energizer, « plate-forme d'information des services de l'énergie et de l'environnement des cantons de Berne… », sur energie-environnement.ch, (consulté le ).
- Voir : Article 10 - Objectifs de collecte., eur-lex.europa.eu, consulté le 28 octobre 2020
- Arrêté du 9 novembre 2009 relatif au transit, au regroupement, au tri et au traitement des piles et accumulateurs usagés, legifrance.gouv.fr, consulté le 28 octobre 2020
- Décret no 2009-1139 du .
- « Synthèse piles et accumulateurs, données 2011 », sur ademe.fr, p. 40.
- Piles : la collecte française se rapprochera de 45 % en 2016 publié par Environnement-magazine le 18/07/2016.
- https://ec.europa.eu/eurostat/web/products-eurostat-news/-/DDN-20200723-1?inheritRedirect=true&redirect=%2Feurostat%2Fnews%2Fwhats-new
Voir aussi
Articles connexes
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- La pile de Volta
- Galvani, Volta et la découverte de la pile électrique.
- Portail de la chimie
- Portail de l’électricité et de l’électronique
- Portail de l’énergie