Atrophie corticale postérieure
L'atrophie corticale postérieure (ACP), également appelée syndrome de Benson[1],[2],[3], est une maladie neurodégénérative rare et évolutive, apparaissant essentiellement entre 50 et 65 ans. C'est une forme de démence parfois considérée comme une variante atypique précoce de la maladie d'Alzheimer[4],[5]. Les causes ou facteurs de risques de cette maladie sont inconnus. Le docteur Frank Benson a décrit pour la première fois ce syndrome en 1988[6].
Épidémiologie
L'ACP est considérée comme une maladie rare. La prévalence est inconnue, par le manque de connaissance du syndrome, d'une terminologie imprécise et de son imbrication dans la maladie d'Alzheimer. Il n'existe pas de définition standard de l'ACP ni de critère de diagnostic établi. Il est donc impossible de connaitre le nombre de personnes atteintes.
Terminologie
- Atrophie corticale postérieure (Benson et al, 1988, Tang-Wai et al 2004)
- Atrophie bipariétale progressive(Mackenzie et al, 1996)
- Dysfonction corticale postérieure(Renner et al, 2004)
- Syndrome de Benson
- Forme visuelle de la Maladie d'Alzheimer (Nestor et al, 2003)
- Forme atypique de la Maladie d'Alzheimer (Galton et al, 2000)
- Apraxie progressive (Ceccaldi et al, 1995)
Symptômes

L'atrophie corticale postérieure affecte des personnes plus jeunes que la maladie d'Alzheimer.
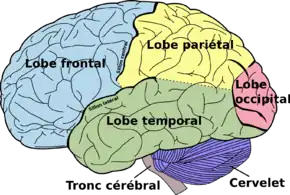
Le premier et principal signe de l'ACP est une altération de la vision : troubles visuo-spatiaux, visuo-cognitives (perturbations des capacités visuo-attentionnelles, visuo-perceptives) car la région postérieure du cerveau abrite le lobe occipital (fig.2), responsable du traitement visuel. L'atrophie est progressive. Les premiers symptômes montrent une difficulté à lire, une vision floue, une sensibilité à la lumière, des problèmes de perception de la profondeur et des difficultés de circulation dans l'espace.
Les symptômes s’aggravent ou de nouveaux apparaissent avec la progression de la neurodégénérescence : apraxie, trouble de la coordination des mouvements, alexie, agnosie visuelle, non reconnaissance d'objets, agraphie, acalculie, indistinction droite gauche, difficultés pour la conduite automobile et du stationnement, difficultés pour lire une horloge à aiguilles, oublis de la fermeture de tiroirs ou de portes (de communication, four, réfrigérateur...). Plus rarement, on observe des hallucinations visuelles.
Quand la destruction neuronale s'étend à d'autres régions corticales antérieures, des symptômes similaires à la maladie d'Alzheimer, tels que la perte de mémoire, peuvent se déclarer.
La prise de conscience des troubles est génératrice de réactions anxieuses et dépressives. L'anxiété et la dépression sont courantes chez les patients atteints d'ACP.
Diagnostic
En janvier 2019, les facteurs à l'origine de l'atrophie corticale postérieure demeurent inconnus.
L’ACP est une maladie rare et sous-reconnue ce qui conduit souvent à un retard significatif dans le diagnostic rendu difficile. Les symptômes apparaissent chez des sujets plus jeunes que dans la maladie d'Alzheimer, les plaintes sont peu spécifiques et le tableau symptomatique est complexe. Il n'existe pas de critères de diagnostic vraiment acceptés et partagés par l'ensemble de la communauté médicale. Une situation due à l'apparition progressive des symptômes, à leur variété et à la nature rare de la maladie. En 2012, la première conférence internationale sur l'ACP[7] s'est tenue à Vancouver, au Canada. La poursuite des études cliniques, des recherches et des tests neuropsychologiques devrait aboutir à l'adoption de critères de diagnostic standardisés.
Les patients ACP sont souvent initialement diagnostiqués à tort pour un trouble de l'anxiété ou une dépression. Certains médecins pensent que les patients souffrent de ces maux en raison de la prise de conscience des premiers symptômes, qu'ils tentent souvent de masquer.
Les déficiences visuelles précoces d’un patient ACP conduisent vers une consultation ophtalmologique. Le médecin ne décèlera aucune anomalie de l’œil[8].
En raison de l'absence de marqueurs biologiques, des examens neuropsychologiques sont utilisés pour l'évaluation.
L'imagerie cérébrale[9] participe également au diagnostic de l'ACP. Les images du cerveau des patients ACP sont souvent comparées aux images des patients atteints de la maladie d' Alzheimer (diagnostic différentiel). Les patients atteints par l'ACP étant plus jeunes, les images prises aux premiers stades de l'ACP seront différentes.
Une observation attentive du patient présentant les symptômes de l'ACP doit être priorisée[10], l'imagerie cérébrale (non pertinente dans certains cas) venant confirmer le diagnostic. La variété des symptômes et le manque d'essais cliniques organisés entraînent des difficultés persistantes et des retards dans le diagnostic de l'ACP[11],[12],[13],[14].
Physiopathologie

L’ACP est provoquée par une accumulation anormale de plaques amyloïdes et d’enchevêtrements neurofibrillaires dans le cortex cérébral. Au fil du temps, cette accumulation entraîne une détérioration et un rétrécissement graduel (atrophie) de la partie postérieure du cerveau (fig.1), entraînant la perte progressive et irréversible de certaines fonctions mentales.
Dérèglements physiologiques
Lorsque le flux ventral (le «quoi») du système visuel situé dans le lobe temporal (fig.1) est atteint les symptômes seront des déficits généraux de la vision et de la reconnaissance d'objet. Les atteintes au flux dorsal (le «où / comment») situé dans le lobe pariétal (fig.1) entraînent des symptômes tels que des mouvements altérés en réponse à des stimuli visuels et l'apraxie. Ce sont deux formes distinctes d’ACP, l’une dorsale et l’autre ventrale (fig.3) puis l’évolution s'oriente vers une ACP globale[15],[16].
Au stade précoce, les patients atteints d'ACP présenteront une atrophie cérébrale plus centrale dans le lobe postérieur droit et le gyrus occipital, tandis que les images cérébrales de la maladie d'Alzheimer révèleront une atrophie dans le cortex temporal médian. Cette variation dans les images aide au diagnostic précoce de l'ACP. Au fil des années, les images deviendront plus similaires. La majorité des patients atteints d'ACP déclarent plus tard une maladie d'Alzheimer en raison d'une atrophie cérébrale progressive et continue. L'imagerie cérébrale des patients atteints d'ACP montrent une perte de matière grise dans les cortex temporaux.
L’imagerie morphologique des structures corticales postérieures soulignent l’importance de l’atteinte des cortex visuels primaires et associatifs, cingulaires postérieurs, temporaux postérieurs et pariétaux, en comparaison avec des sujets sains du même âge. Une atteinte plus marquée de l’hémisphère droit est également rapportée.
Liens avec la maladie d'Alzheimer
Certains médecins pensent que l'ACP est une variante de la maladie d’Alzheimer débutant par les déficits visuels. D'autres optent pour une maladie à part entière, dérivant vers un Alzheimer. Bien que les régions du cerveau atteintes soient différentes, parfois se chevauchant, elles impliquent dans les deux maladies une dégénérescence progressive des neurones. On observe une perte de neurones et de synapses ainsi que la présence d'enchevêtrements neurofibrillaires et de plaques amyloïdes. Les patients atteints d'ACP présentent davantage de lésions corticales et de pertes de substance grise (corps cellulaire) dans les régions postérieures, en particulier dans les lobes occipital, pariétal et temporal. Les patients atteints de la maladie d'Alzheimer sont davantage lésés dans le cortex préfrontal et l'hippocampe. L'ACP altère la mémoire de travail et la mémoire antérograde, tout en laissant la mémoire épisodique intacte. Les patients atteints de la maladie d'Alzheimer ont plutôt une mémoire épisodique endommagée. Les zones principales et premières de lésion corticale sont différentes selon la maladie. Avec le temps, l’atrophie neuronale des patients atteints d'ACP se propage dans d'autres régions et provoque alors des symptômes communs aux deux maladies.
L'ACP peut également être corrélée aux maladies à corps de Lewy, à la maladie de Creutzfeldt-Jakob, à la dégénérescence cortico-basale (DCB), au syndrome de Balint[17],[18] et au syndrome de Gerstmann.
Traitement
En partenariat avec le médecin généraliste traitant, le patient atteint d'ACP sera suivi par un neurologue.
À ce jour (janvier 2019), aucun traitement pour stopper, inverser, guérir la PCA n'existe. Des médicaments utilisés pour la maladie d'Alzheimer sont parfois proposés aux patients ACP, tels que les inhibiteurs de la cholinestérase, le donépézil, la rivastigmine, la galantamine et la mémantine. Les antidépresseurs ont parfois des effets positifs. En décembre 2019, Samantha Budd Haeberlein, du laboratoire américain Biogen Inc., a présenté les résultats de deux essais de phase III. La molécule appelée aducanumab s'y est révélée efficace, après avoir été testée sur 1.350 patients. D'autres études sur les effets de cette molécule sont toujours en cours (mars 2020)[19].
Les patients peuvent être soulagés par des traitements non médicamenteux tels que des aides psychologiques, de l'ergothérapie, de l'orthophonie, l'assistance d'une équipe sensorielle afin de les aider à s'adapter aux symptômes de l'ACP. Les personnes atteintes de l'ACP et leurs soignants ont des besoins spécifiques, différents de la maladie d'Alzheimer de par les symptômes et leur précocité. Le maintien à domicile, possible jusqu'à certains stades de la maladie, reste éprouvant pour l'entourage. Des groupes de soutien spécialisés peuvent être utiles[20].
Dans le cadre du Plan National Maladies Rares[21] (PNMR), un centre de référence des démences rares[22], localisé à l'hôpital de la Salpêtrière travaille en collaboration avec 12 centres de compétence régionaux pour améliorer la prise en charge des patients et des familles sur toute la France.
Axes de recherches
Des recherches[23] sont en cours sur les mutations des gènes[24] PGRN (progranuline)[25], PSEN1 (préséniline 1)[26], PSEN2, APP. Les mutations dans ces gènes aboutissent à la surproduction des peptides amyloïdes et de protéine tau.
En 2010 a été créé le programme IGAP (International Genomics Alzheimer Project)[27] regroupant 4 grands consortiums de chercheurs. Un autre axe de recherche s'oriente vers l’immunothérapie visant à détruire les agrégats pathologiques de protéines (peptide bêta-amyloïde).
Une équipe de chercheurs américains a publié une étude dans Science Advances du 23 janvier 2019[28] dans laquelle ils pointent la bactérie Porphyromonas gingivalis, responsable de maladies chroniques des gencives. Celle-ci migrerait dans le cerveau et y provoquerait des inflammations cérébrales, des lésions neuronales et donc un déclin cognitif. L'entreprise pharmaceutique Cortexyme, basée à San Francisco, a trouvé les enzymes toxiques, les gingipaines (produites par Porphyromonas gingivalis) dans 96 % des 54 échantillons de cerveaux atteints par la maladie d’Alzheimer. De plus, ils ont trouvé les bactéries elles-mêmes dans trois cerveaux. Les chercheurs ont également trouvé la bactérie dans le liquide céphalo-rachidien de personnes vivantes atteintes de la maladie d’Alzheimer. Un bloqueur de la gingipaïne a été testé sur l’humain. Les participants atteints de la maladie d’Alzheimer ont vu leur état s'améliorer. Les chercheurs poursuivent leurs recherches, notamment en augmentant le nombre d'échantillons testés[29],[30]. En Australie, une équipe de Melbourne, a développé un vaccin contre la bactérie, en test depuis 2018.
Bibliographie
- Puvilland Lise-Marlène, thèse du 17 octobre 2014, SYNDROME DE BENSON : DU DIAGNOSTIC PRECOCE A LA PRISE EN CHARGE,EXPERIENCE LYONNAISE ET REVUE DE LA LITTERATURE[31]
- Oliver Sacks[32] L'œil de l'esprit Paris éditions Points 2014 (ISBN 978-2-7578-3784-9), L’homme qui prenait sa femme pour un chapeau Paris éditions Points, 2014 (ISBN 978-2-7578-4021-4)
- Domas[33] Le syndrome du petit pois éditions Boite À Bulles 2016 (ISBN 978-2-84953-250-8)
- Annie-Claude Nakau et Marie Bernard[34] J'y pense et puis j'oublie éditions Slatkine & Cie 2017 (ISBN 978-2-88944-027-6)
- Bernard Croisile[35] Alzheimer et les maladies apparentées éditions Larousse 2007 (ISBN 978-2-03-582297-0)
- Didier Maillet, Christine Moroni, Catherine Belin revue Psychologie & neuropsychiatrie du vieillissement[36] Vol 7, No 3, septembre 2009, pages 193-203 ISSN 1760-1703
- Reeves Simon, mémoire présenté en vue de l’obtention du grade de maîtrise en psychologie (M.Sc.), Université de Montréal, Département de psychologie, Faculté des Arts et des Sciences, aout 2016[37].
Liens externes
- description maladie sur Orphanet : https://www.orpha.net/consor/www/cgi-bin/OC_Exp.php?lng=FR&Expert=54247
- Article de Didier Maillet, Christine Moroni, Catherine Belin : http://www.jle.com/fr/revues/pnv/e-docs/latrophie_corticale_posterieure_282123/article.phtml
- Laboratoire de recherche sur les traitements : http://www.institut-biotherapies.fr/
- groupe d'aidants et de malades sur facebook (fermé) : https://www.facebook.com/groups/343857153792/
- Pdf : Atrophie Corticale Postérieure François SELLAL CMRR de Strasbourg-Colmar Hôpitaux Civils de Colmar : http://lnfp.fr/img/uploads/2017/02/ACP_NPP3fevr_FSellal.pdf
- INSERM communiqué de presse sur Alzheimer : identification d’agrégats de protéines cibles potentielles pour soigner la maladie https://presse.inserm.fr/alzheimer-identification-dagregats-de-proteines-cibles-potentielles-pour-soigner-la-maladie/33410/
Notes et références
- ref ORPHA:54247
- Psychologie & NeuroPsychiatrie du vieillissement vol 7 No 3 sept2009 <<L'atrophie corticale postérieure>> Didier Maillet, Christine Moroni, Catherine Belin UF mémoire et maladie neurodégénérative, Service de neurologie, CHU Avicenne, AP-HP, Bobigny, JE 2497 neuropsychologie et cognition auditive, UFR de psychologie, Université Nord de France, Lille
- (en)« Posterior Cortical Atrophy », UCSF Memory and Aging Center, University of California, San Francisco (consulté le )
- (en) « Visual variant of Alzheimer’s disease - EyeWiki », sur eyewiki.aao.org (consulté le )
- Nestor PJ, Caine D, Fryer TD, Clarke J, Hodges JR, « The topography of metabolic deficits in posterior cortical atrophy (the visual variant of Alzheimer's disease) with FDG-PET », J Neurol Neurosurg Psychiatry, vol. 74, , p. 1521–1529 (PMCID 1738241, DOI 10.1136/jnnp.74.11.1521, lire en ligne)
- 1. Benson DF, Davis RJ, Snyder BD. Posterior cortical atrophy.Arch Neurol 1988 ; 45 : 789-93.
- https://www.alzforum.org/news/conference-coverage/researchers-join-draw-posterior-cortical-atrophy-out-shadows
- journal Français d'Ophtalmologie Volume 35, no 4 pages 308-311 (avril 2012)
- Thèse : Querbes, Olivier (2009). Mesure de l'épaisseur corticale en IRM : application au diagnostic précoce individuel de la maladie d'Alzheimer et à la notion de réserve cognitive (http://thesesups.ups-tlse.fr/1597/)
- Croisile B. Le syndrome de Benson (ou atrophie corticale postérieure) : quelles questions poser aux patients pour repérer ce syndrome rare et méconnu ? Neurologies 2008 ; 11 : 424-8.
- MD. Bernard Croisile et Alexis Brice, « Benson's syndrome or Posterior Cortical Atrophy », Orphanet Encyclopedia, (lire en ligne, consulté le )
- Martin A. Goldstein, Iliyan Ivanov et Michael E. Silverman, « Posterior Cortical Atrophy: An Exemplar for Renovating Diagnostic Formulation in Neurosychiaty », Comprehensive Psychiatry, vol. 52, no 3, , p. 326–333 (DOI 10.1016/j.comppsych.2010.06.013, lire en ligne, consulté le )
- Möller C, van der Flier WM, Versteeg A, Benedictus MR, Wattjes MP, Koedam EL, Scheltens P, Barkhof F, Vrenken H, « Quantitative Regional Validation of the Visual Rating Scale for Posterior Cortical Atrophy », European Radiology, vol. 24, no 2, , p. 397–404 (PMID 24092044, DOI 10.1007/s00330-013-3025-5, lire en ligne)
- Migliaccio R, Agosta F, Toba MN, Samri D, Corlier F, de Souza LC, Chupin M, Sharman M, Gorno-Tempini ML, Dubois B, Filippi M, Bartolomeo P, « Brain Networks in Posterior Cortical Atrophy: A Single Case Tractography Study and Literature Review », Cortex, vol. 48, no 10, , p. 1298–1309 (PMID 22099855, PMCID 4813795, DOI 10.1016/j.cortex.2011.10.002)
- Goenthals, Maartin; Patrick Santens (20 February 2001). "Posterior cortical atrophy. Two case reports and a review of the literature". Clinical Neurology and Neurosurgery. 103: 115–119. https://www.sciencedirect.com/science/article/pii/S0303846701001147?via%3Dihub.
- name="Borruat 2013">François-Xavier Borruat, « Posterior Cortical Atrophy: Review of the Recent Literature », Neuro-Ophthalmology, vol. 13, , p. 406 (PMID 24136454, DOI 10.1007/s11910-013-0406-8)
- « Syndrome de Balint », sur Futura (consulté le ).
- « Le syndrome de Bálint : la vision désorientée », sur cerveauetpsycho.fr, Pour la Science (consulté le ).
- « Alzheimer : enfin un médicament porteur d’espoir ? », Les Échos, (lire en ligne, consulté le ).
- groupe facebook (fermé) https://www.facebook.com/groups/343857153792
- Plan National Maladies Rares [PDF].
- Cref-demarres.
- http://www.institut-biotherapies.fr/biotherapies/la-therapie-genique/
- Centre National de Référence pour les Malades Alzheimer Jeunes (CNRMAJ) Pr Didier HANNEQUIN, neurologue, PU-PH service de Neurologie, coordonnateur du CNRMAJ http://www.alzheimer-genetique.fr/
- PGRN : UF Biochimie des maladies neurométaboliques / Département de Biochimie métabolique / CHU Paris-GH La Pitié Salpêtrière-Charles Foix - Hôpital Pitié-Salpêtrière / Dr Foudil LAMARI sous la direction du Dr Claude JARDEL
- http://www.alzheimer-genetique.fr/professionnels-de-sante/fad-alzheimer-dominant/psen1
- Communiqué de presse de l'INSERM du 01 févr. 2011 https://presse.inserm.fr/lancement-de-la-premiere-collaboration-internationale-sur-la-genetique-de-la-maladie-dalzheimer/13765/
- (en) Stephen S. Dominy1, Casey Lynch1, Florian Ermini..., Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small-molecule inhibitors, advances.sciencemag.org,
- « Avancée inouïe pour la médecine : l’origine de la maladie d’Alzheimer a peut-être été identifiée... - Handicap Info », sur Handicap Info, (consulté le ).
- Alzheimer : la piste des bactéries buccales se confirme, sciencesetavenir.fr, 30 janvier 2019
-

- (1933-2015) Neurologue et écrivain britannique, professeur à l'université Columbia.Dans L'œil de l'esprit, Oliver Sacks présente un cas d'atrophie corticale postérieure.
Il aborde également l'ACP dans L’homme qui prenait sa femme pour un chapeau - auteur français de bande dessinée, né le 22 juin 1973. Un récit sur les personnes atteintes de maladies neurodégénératives et sur l'impact de celles-ci sur leur entourage
- L'auteure est elle-même atteinte du syndrome de Benson à 45 ans. Ouvrage rédigé en collaboration avec Marie Bernard
- neurologue et neuropsychologue français, exerçant aux Hospices civils de Lyon
- https://www.jle.com/fr/revues/pnv/sommaire.phtml?cle_parution=3189
-

- Portail des associations
- Portail de la médecine
- Portail des neurosciences