Aminophénol
L'aminophénol ou hydroxyaniline est un composé aromatique de formule HOC6H4NH2. Il est constitué d'un cycle benzénique substitué par un groupe hydroxyle (phénol) et un groupe amine (aniline). Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
Propriétés
| Aminophénol | |||
| Nom | 2-Aminophénol | 3-Aminophénol | 4-Aminophénol |
| Autres noms | o-Aminophénol Ortho-aminophénol 2-Hydroxyaniline |
m-Aminophénol Méta-aminophénol 3-Hydroxyaniline |
p-Aminophénol Para-aminophénol 4-Hydroxyaniline |
| Représentation |  |
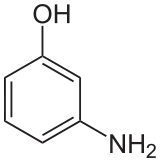 |
|
| Numéro CAS | |||
(mélange d'isomères)[1] | |||
| PubChem | 5801 | 11568 | 403 |
| Formule brute | C6H7NO | ||
| Masse molaire | 109,13 g mol−1 | ||
| État | solide | ||
| Apparence | solide incolore | ||
| Point de fusion | 172 à 174 °C[2] | 122 °C[3] | 190 °C[4] |
| Point d'ébullition | > 300 °C (décomp.)[2] | 164 °C (15 hPa)[3] | 284 °C (décomp.)[4] |
| Masse volumique | 1,328 g cm−3 (20 °C)[2] | 0,99 g cm−3 (25 °C)[3] | 1,29 g cm−3 (20 °C)[4] |
| Point d'éclair | > 175 °C (coupelle fermée)[2] | 178 °C[3] | 195 °C (coupelle fermée)[4] |
| Point d'auto-inflammation | 190 °C[2] | 164 °C (15 hPa)[3] | > 250 °C[4] |
| pKa | 9,71[5] | 9,87[5] | 10,30[6] |
| Solubilité dans l'eau | 17 g l−1 (20 °C)[2] | 26 g l−1 (25 °C)[3] | 16 g l−1 (25 °C)[4] |
| LogP | 0,62[2] | 0,17[3] | 0,04[4] |
| SGH |
  [2] |
  [3] |
   [4] |
| Phrases H et P | H302, H332 et H341 |
H302, H332 et H411 |
H302, H317, H332, H341, H373 et H410 |
| P281 |
P273 |
P273, P280, P314 et P302+P352 | |
Les aminophénols se présentent sous la forme de solides incolores ; ils virent au gris à gris foncé exposés à l'air. Ils sont peu solubles dans l'eau, mais solubles dans l'éthanol et l'éther. Du fait qu'ils possèdent un grouphe hydroxyle et un groupe amine, ils sont solubles dans les acides et les bases. En milieu basique, le 2- et 4-aminophénol peuvent être transformés de façon réversible en quinonimines (de) correspondantes (voir indophénol et quinones).
Les aminophénols, en particulier les isomères ortho et para, ont des points de fusion relativement élevés comparés à des composés similaires (orthocrésol : 31 °C, orthonitrophénol : 44 °C, contre 172 à 174 °C pour l'ortho-aminophénol). Ceci s'explique par les nombreuses liaisons hydrogène intra- et intermoléculaires entre les différents groupes amine et hydroxyle.
Nom
Contrairement à d'autres dérivés disubstitués du benzène, l'aminophénol ne s'est jamais vu accorder un nom trivial. Sur le modèle de l'anisidine et de la toluidine, respectivement les dérivés aminés de l'anisole, et du toluène, il aurait pu être construit le terme « phénidine » à partir de phénol, mais cela n'est jamais arrivé. Toutefois, « phénidine » existe en chimie, mais est un des synonymes triviaux d'un autre composé, le N-(4-éthoxyphényl)acétamide, plus connu sous le nom de phénacétine.
Synthèse
Les aminophénols peuvent facilement être obtenus par réduction des nitrophénols correspondants, eux-mêmes produits par nitration du phénol. Par exemple, le 4-aminophénol est produit par réduction électrolytique du 4-nitrophénol en présence d'acide sulfurique concentré[7].
Le 4-aminophénol peut également être produit réduction du nitrobenzène par le zinc en présence de NH4Cl. La réaction produit une phénylhydroxylamine qui se réarrange rapidement en aminophénol.
Le 3-aminophénol peut être préparé par fusion caustique de l'acide 3-aminobenzènesulfonique (c'est-à-dire en le chauffant avec NaOH à 245 °C pendant 6 heures)[8] ou à partir de la résorcine par réaction de substitution avec l'ammoniaque[9].
Utilisations

Les aminophénols sont des intermédiaires dans la préparation de nombreux autres composés.
- L'indophénol, un colorant bleu peut être produit par couplage oxydatif du 4-aminophénol avec le phénol en milieu basique, l'hypochlorite de sodium servant d'oxydant. De nombreux colorants azoïques sont aussi synthétisés à partir des aminophénols.
- Le 2-aminophénol est un intermédiaire dans la synthèse de colorants ; il permet en particulier d'obtenir des colorants constitués de complexes métalliques après avoir été diazotizé et couplé au phénol, naphtol, ou d'autre composés aromatuques ou résonnants.
- Du fait de la proximité des groupes amine et hydroxyle, le 2-aminophénol permet de produire assez facilement des composés hétérocycliques tels que le benzoxazole ou la benzoxazine et leurs dérivés. Ces composés peuvent être biologiquement actifs et sont utilisés dans l'industrie pharmaceutique[10].
- La phénacétine et le paracétamol, deux antalgiques, sont synthétisés à partir du 4-aminophénol
- Le 4-aminophénol peut servir de développeur en photographie noir et blanc. Il est utilisé pour ceci sous le nom de Rodinal[7]. C'est également le cas poyr le 2-aminophénol, sous les noms Atomal et Ortol[10].
- L'une de principales applications du 3-aminophénol est la synthèse du 3-(diéthylamino)phenol, un intermédiaire-clé dans la synthèse de colorants fluorescents, comme la rhodamine B. Il est également utilisé dans certains colorants pour cheveux, et comme stabiliseur dans certains thermoplastiques contenant du chlore[8].
- La polycondensation des aminophénols avec le formaldéhyde produit des résines synthétiques ; ces composés sont en particulier utilisées comme résines échangeuses d'ions.
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Aminophenole » (voir la liste des auteurs).
- Entrée « Aminophenol, isomers » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 janvier 2020 (JavaScript nécessaire).
- Entrée « 2-Aminophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 janvier 2020 (JavaScript nécessaire).
- Entrée « 3-Aminophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 janvier 2020 (JavaScript nécessaire).
- Entrée « 4-Aminophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 janvier 2020 (JavaScript nécessaire).
- CRC Handbook of Tables for Organic Compound Identification, 3e éd., 1984 (ISBN 0-8493-0303-6).
- chem.wisc.edu: pKa Data, Compiled by R. Williams (PDF, 78 kB).
- Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, (ISBN 3-7776-0356-2), p. 527.
- Stephen C. Mitchell et Rosemary H. Waring, « Aminophenols », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a02_099)
- Haruhisa Harada, Maki Hiroshi et Shigeru Sasaki, « Method for the production of m-aminophenol EP0197633A1 », sur Google Patents, Sumitomo Chemical Company, Limited, (consulté le )
- Mitchell, S.C. & Waring, R.H. "Aminophenols." In Ullmann’s Encyclopedia of Industrial Chemistry; 2002 Wiley-VCH, DOI:10.1002/14356007.a02_099.