Éther diisopropylique
L'éther diisopropylique, ou plus simplement éther isopropylique, est un composé organique de formule chimique (CH3)2CH–O–CH(CH3)2. Il se présente comme un liquide incolore volatil très inflammable susceptible de former des mélanges explosifs avec l'air. Il est faiblement soluble dans l'eau mais miscible avec les solvants organiques. Il est utilisé comme solvant pour les huiles animales, végétales et minérales, les graisses, les cires et certaines résines naturelles. Il n'est généralement pas considéré comme un solvant pour les résines synthétiques, bien qu'il dissolve l'éthylcellulose ainsi que la nitrocellulose en présence d'alcools légers. Plus spécifiquement, il est utilisé comme solvant sélectif pour éliminer ou retirer les composé organiques polaires des solutions aqueuses comme les phénols, l'éthanol ou l'acide acétique. Il peut être préféré à l'éther diéthylique pour sa moindre volatilité. Il a également été utilisé comme additif pour carburant pour son effet antidétonant. On l'obtient industriellement comme sous-produit de la fabrication de l'isopropanol par hydratation du propène CH2=CH–CH3[3].
| Éther diisopropylique | |
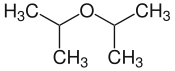
| |
| Structure de l'éther diisopropylique | |
| Identification | |
|---|---|
| Nom UICPA | 2-propan-2-yloxypropane |
| Synonymes |
éther isopropylique |
| No CAS | |
| No ECHA | 100.003.237 |
| No CE | 203-560-6 |
| No RTECS | TZ5425000 |
| PubChem | 7914 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore volatil très inflammable à l'odeur d'éther[1] |
| Propriétés chimiques | |
| Formule | C6H14O [Isomères] |
| Masse molaire[2] | 102,1748 ± 0,0061 g/mol C 70,53 %, H 13,81 %, O 15,66 %, |
| Propriétés physiques | |
| T° fusion | −86 °C[1] |
| T° ébullition | 69 °C[1] |
| Solubilité | 12 g·L-1[1] à 20 °C |
| Masse volumique | 0,72 g·cm-3[1] à 20 °C |
| T° d'auto-inflammation | 405 °C[1] |
| Point d’éclair | < −20 °C[1] |
| Limites d’explosivité dans l’air | entre 1 % et 21 % en volume (45 à 900 g/m3)[1] |
| Pression de vapeur saturante | 175 hPa[1] à 20 °C |
| Précautions | |
| SGH[1] | |
  Danger |
|
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 8 470 mg·kg-1[1] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
L'éther diisopropylique a tendance à former des peroxydes, même dans l'obscurité après suffisamment longtemps[4]. Pour éviter cela, on ajoute de l'hydroquinone ou d'autres antioxydants. Dans l'air, il forme des peroxydes explosifs plus facilement que l'éther diéthylique en raison des atomes de carbone secondaires adjacents à l'atome d'oxygène. Il est recommandé de tester tous les trois mois la présence de peroxydes dans l'éther diisopropylique stocké, contre tous les ans pour l'éther diéthylique[5]. Il est possible d'éliminer les peroxydes en agitant l'éther avec une solution aqueuse de sulfate de fer(II) FeSO4 ou de métabisulfite de sodium Na2S2O5[6],[7]. Le méthyl tert-butyl éther CH3OC(CH3)3 est souvent utilisé comme solvant alternatif à l'éther diisopropylique pour raison de sécurité.
Notes et références
- Entrée « Diisopropyl ether » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10 mars 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Michael Sakuth, Thomas Mensing, Joachim Schuler, Wilhelm Heitmann, Günther Strehlke et Dieter Mayer, « Ethers, Aliphatic », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a10_023.pub2, lire en ligne)
- (de) T. H. Brock, Sicherheit und Gesundheitsschutz im Laboratorium: Die Anwendung der Richtlinien für Laboratorien, Springer, 1997. (ISBN 978-3-540-61952-9)
- (en) « Organic Peroxides - Hazards », sur https://www.ccohs.ca/, CCOHS (en), (consulté le ).
- (en) Christina Li Lin Chai et W. L. F. Armarego, Purification of laboratory chemicals, Butterworth-Heinemann, Oxford, 2003, p. 176. (ISBN 978-0-7506-7571-0)
- (en) A. C. Hamstead, « Destroying Peroxides of Isopropyl Ether », Industrial and Engineering Chemistry, vol. 56, no 6, , p. 37-42 (DOI 10.1021/ie50654a005, lire en ligne)
- Portail de la chimie
