Époxydation de Sharpless
L'époxydation de Sharpless est une réaction chimique énantiosélective qui permet de préparer des 2,3-époxyalcools à partir d'alcools allyliques primaires et secondaires[1],[2]. Cette réaction fut découverte par K. Barry Sharpless et son équipe, qui partagea en 2001 le prix Nobel de chimie pour son travail sur les oxydations asymétriques, avec William S. Knowles et Ryōji Noyori pour leur travaux sur les hydrogénations asymétriques (hydrogénation asymétrique de Noyori).
Pour les articles homonymes, voir Sharpless.
La stéréochimie de l'époxyde produit est déterminée par le diastéréoisomère du tartrate de diéthyle utilisé dans la réaction plutôt que de la stéréochimie du réactif. Cette réaction s'effectue avec un bon rendement et une bonne diastéréosélectivité sur une large gamme de réactifs.
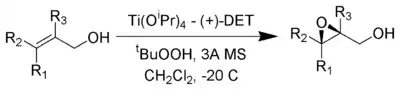
Réactifs
L'oxydant de la réaction est le tert-butylhydroperoxyde. L'énantiosélectivité est assurée par un catalyseur à base de tétraisopropoxyde de titane et de tartrate de diéthyle. Seulement 5-10 % en moles de catalyseur en présence d'un tamis moléculaire de 3 Å est nécessaire[3].
Mécanisme
L'équipe de Sharpless travaille à la fois sur la cinétique de la réaction[4] et sur la structure du catalyseur[5].
Utilité
Les époxydes peuvent être facilement convertis en diols, aminoalcools ou éther-oxydes, la formation d'époxydes chiraux est donc une étape importante dans la synthèse de produits naturels.
Notes et références
- (en) T. Katsuki et K. B. Sharpless, « The first practical method for asymmetric epoxidation », J. Am. Chem. Soc., vol. 102, no 18, , p. 5974-5976 (ISSN 0002-7863, DOI 10.1021/ja00538a077).
- (en) J. G. Hill, K. B. Sharpless et al., « Enantioselective Epoxidation of Allylic Alcohols: (2S,3S)-3-Propyloxiranemethanol », Org. Syn., vol. 63, , p. 66 (ISSN 0078-6209, DOI 10.15227/orgsyn.063.0066).
- (en) Y. Gao, J. M. Klunder et al., « Catalytic asymmetric epoxidation and kinetic resolution: modified procedures including in situ derivatization », J. Am. Chem. Soc., vol. 109, no 19, , p. 5765–5780 (ISSN 0002-7863, DOI 10.1021/ja00253a032).
- (en) S. S. Woodard, M. G. Finn et al., « Mechanism of asymmetric epoxidation. 1. Kinetics », J. Am. Chem. Soc., vol. 113, no 1, , p. 106–113 (ISSN 0002-7863, DOI 10.1021/ja00001a018).
- (en) M. G. Finn et K. B. Sharpless, « Mechanism of asymmetric epoxidation. 2. Catalyst structure », J. Am. Chem. Soc., vol. 113, no 1, , p. 113–126 (ISSN 0002-7863, DOI 10.1021/ja00001a019).
Bibliographie
- Johnson, R. A.; Sharpless, K. B. Comp. Org. Syn. 1991, 7, 389-436. (Review)
- (en) E. Höft, Topics in Current Chemistry, vol. 164 : Organic Peroxygen Chemistry, Springer, , 130 p. (ISBN 978-3-540-56252-8, DOI 10.1007/3-540-56252-4_25), « Enantioselective epoxidation with peroxidic oxygen », p. 63-77.
- (en) T. Katsuki et V. Martin, Organic Reactions, vol. 48, New York, NY, John Wiley & Sons, (ISBN 978-0-471-14699-5, DOI 10.1002/0471264180.or048.01), chap. 1 (« Asymmetric Epoxidation of Allylic Alcohols: the Katsuki–Sharpless Epoxidation Reaction »), p. 1–299.
- (en) A. Pfenninger, « Asymmetric Epoxidation of Allylic Alcohols: The Sharpless Epoxidation », Synthesis, no 2, , p. 89-116 (ISSN 0039-7881, DOI 10.1055/s-1986-31489).
- Portail de la chimie