Vismodégib
Le vismodégib, inhibiteur systémique de la signalisation hedgehog, est un médicament antinéoplasique oral utilisé en cas de carcinome basocellulaire, un cancer de la peau de pronostic favorable lorsqu'il est traité.
| Vismodégib | ||
 | ||
 | ||
| Identification | ||
|---|---|---|
| DCI | vismodegib | |
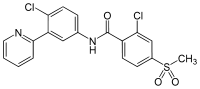
| Nom UICPA | 2-chloro-N-(4-chloro-3-pyridin-2-ylphényl)-4-méthylsulfonylbenzamide | |
| Synonymes |
GDC-0449, GDC0449, GDC 0449, 879085-55-9, RG-3616, Vismodegibum |
|
| No CAS | ||
| PubChem | 24776445 131480672 | |
| ChEBI | 66903 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule brute | C19H14Cl2N2O3S |
|
| Masse molaire[1] | 421,297 ± 0,026 g/mol C 54,17 %, H 3,35 %, Cl 16,83 %, N 6,65 %, O 11,39 %, S 7,61 %, |
|
| Données pharmacocinétiques | ||
| Demi-vie d’élim. | 12 jours[2] | |
| Excrétion | ||
| Considérations thérapeutiques | ||
| Voie d’administration | per os | |
| Grossesse | contre-indication | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Historique
Identifiée au début des années 2000 par la compagnie américaine Curis Inc.[3], les droits exclusifs sont cédés à Genentech aux États-Unis qui revend aux laboratoires Roche une licence pour les autres marchés[4]. Ces deux derniers laboratoires sont chargés du développement clinique et commercial, de l'agrément, de la synthèse à grande échelle et de la fourniture des clients finaux de la molécule[4].
Synthèse
| vismodégib | |
| Noms commerciaux |
|
|---|---|
| Laboratoire | Hoffmann-La Roche, Roche |
| Forme | gélules dosée à 150 mg |
| Administration | per os |
| Classe | inhibiteur systémique de la signalisation hedgehog, autres antinéoplasiques, ATC code L01XX43 |
Indications
Le vismodégib est admis à l'usage par la FDA puis par l'Agence européenne des médicaments[5] dans le cadre spécifique du traitement antinéoplasique des carcinomes basocellulaires[6],[7] pour lesquels ni chirurgie ni radiothérapie ne pourraient être pratiquées[8]. Des essais ont été effectués pour élargir éventuellement les indications aux cancers colorectaux métastasés[9], aux carcinomes pulmonaires à petites cellules[10], sans succès.
Mise en garde et précautions d'emploi
Contre-indications
- grossesse et allaitement (les patientes ne sont pas autorisées à allaiter durant les 7 mois qui suivent la dernière dose d’Erivedge[2]) ;
- traitement chez l'enfant.
Effets secondaires indésirables
Sont plutôt communs (survenant chez plus de 30 % des patients traités)[11] :
- spasmes musculaires ;
- chute de cheveux ;
- déformation du goût ;
- perte de poids ;
- nausées ;
- aménorrhée secondaire (absence de règles).
Peuvent survenir (dans environ 10 à 29 % des cas)[11] :
- diarrhée ;
- déshydratation ;
- perte d'appétit ;
- constipation ;
- douleurs articulaires ;
- vomissements ;
- perte du goût.
Posologie
Une gélule de 150 mg par jour au cours ou à distance des repas[2].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Information professionnelle sur Erivedge », sur ch.oddb.org/fr Ywesee, (consulté le 18 juillet 2013)
- (en) Williams JA, Guicherit OM, Zaharian BI, Xu Y, Chai L, Wichterle H, Kon C, Gatchalian C, Porter JA, Rubin LL, Wang FY., « Identification of a small molecule inhibitor of the hedgehog signaling pathway: effects on basal cell carcinoma-like lesions », Proc Natl Acad Sci U S A., vol. 100, no 8, , p. 4616-21. (PMID 12679522, lire en ligne)
- (en) « Current Corporate Collaborators: Genentech (Erivedge®, vismodegib) », sur www.curis.com (consulté le 18 juillet 2013)
- (en) « Erivedge (vismodegib): EMA Opinion », (consulté le 18 juillet 2013)
- (en) Von Hoff DD, LoRusso PM, Rudin CM, Reddy JC, Yauch RL, Tibes R, Weiss GJ, Borad MJ, Hann CL, Brahmer JR, Mackey HM, Lum BL, Darbonne WC, Marsters JC Jr, de Sauvage FJ, Low JA., « Inhibition of the hedgehog pathway in advanced basal-cell carcinoma », N Engl J Med., vol. 361, no 12, , p. 1164-72. (PMID 19726763, DOI 10.1056/NEJMoa0905360, lire en ligne)
- (en) Sekulic A, Migden MR, Oro AE, Dirix L, Lewis KD, Hainsworth JD, Solomon JA, Yoo S, Arron ST, Friedlander PA, Marmur E, Rudin CM, Chang AL, Low JA, Mackey HM, Yauch RL, Graham RA, Reddy JC, Hauschild A., « Efficacy and safety of vismodegib in advanced basal-cell carcinoma », N Engl J Med., vol. 366, no 23, , p. 2171-9. (PMID 22670903, DOI 10.1056/NEJMoa1113713, lire en ligne)
- (en) Keating GM., « Vismodegib: in locally advanced or metastatic basal cell carcinoma », Drugs, vol. 72, no 11, , p. 1535-41. (PMID 22788238, DOI 10.2165/11209590-000000000-00000, résumé)
- (en) Berlin J, Bendell JC, Hart LL, Firdaus I, Low JA et al., « A randomized phase II trial of vismodegib versus placebo with FOLFOX or FOLFIRI and bevacizumab in patients with previously untreated metastatic colorectal cancer », Clin Cancer Res, vol. 19, no 1, , p. 258-67. (PMID 23082002, DOI 10.1158/1078-0432.CCR-12-1800, lire en ligne [html])
- (en) Belani CP, Dahlberg SE, Rudin CM, Fleisher M, Chen HX, Takebe N, Ramalingam SS, Schiller JH, « Three-arm randomized phase II study of cisplatin and etoposide (CE) versus CE with either vismodegib (V) or cixutumumab (Cx) for patients with extensive stage-small cell lung cancer (ES-SCLC) (ECOG 1508) », J Clin Oncol, vol. 31 (suppl; abstr 7508), (résumé)
- (en) « vimodegib », sur chemocare.com (consulté le 18 juillet 2013)
Liens externes
- Page spécifique dans la base de données sur les produits pharmaceutiques (Canada)
- Compendium suisse des médicaments : spécialités contenant Vismodégib
- Page spécifique sur le Répertoire Commenté des Médicaments, par le Centre belge d'information pharmacothérapeutique
- Page spécifique sur le Vidal.fr
- Portail de la chimie
- Portail de la pharmacie
- Portail de la médecine