Rickettsia
Les rickettsies (Rickettsia) forment un genre de bactéries de la famille de Rickettsiaceae et de la tribu des Rickettsieae. Les rickettsies sont, comme les chlamydies, des bactéries parasites intracellulaires obligatoires et de petite taille (300 nm). Elles vivent dans le cytoplasme même des cellules eucaryotes. Elles sont principalement rencontrées chez les arthropodes qui en sont les vecteurs (en particulier les hématophages : tiques, poux et acariens) provoquant diverses maladies chez l'humain et l'animal (rickettsioses).
| Règne | Bacteria |
|---|---|
| Embranchement | Proteobacteria |
| Classe | Alpha Proteobacteria |
| Ordre | Rickettsiales |
| Famille | Rickettsiaceae |
| Tribu | Rickettsieae |
Genre
da Rocha-Lima, 1916
Leur nom vient de Howard Taylor Ricketts (1871-1910).
Caractères bactériologiques
Morphologie
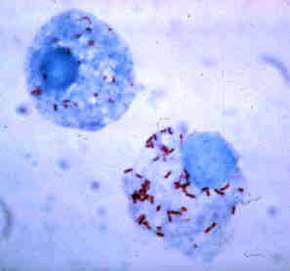
Ce sont des bacilles courts, susceptibles de changer de forme (pléiomorphes), de la forme en bâtonnet à la forme sphérique (coccoïdes)[1], de très petite taille (0,3 à 0,5 μm de diamètre sur 0,8 à 2 μm de long)[2].
Elles sont incapables de prendre la coloration de Gram, elles sont cependant colorées par le colorant de Giemsa (en violet) et ont des similitudes avec les bactéries à Gram négatif. La température optimale de croissance varie de 32 à 35 °C.
Ce sont des bactéries intracellulaires, qui ne se multiplient que dans les cellules eucaryotes, par simple scissiparité (temps de génération de 8 à 10 heures). Les Rickettsia du groupe typhus ne se trouvent que dans le cytoplasme, celles du groupe boutonneux sont présentes aussi dans le noyau des cellules infectées.
Culture et métabolisme
Les rickettsies n'utilisent pas le glucose comme source d'énergie. Elles oxydent plutôt le glutamate, le succinate... Bien que capable de synthétiser de l'ATP, une grande partie de l'ATP utilisé provient de la cellule parasitée[2],[3].
Leur culture n'est possible que dans des cultures cellulaires, ou la cavité vitelline d'un œuf embryonné d'un animal adapté (hôte habituel dans la nature) : souris, rat ou cobaye[1].
Ces particularités (intracellulaires et de très petite taille) ont fait que les rickettsies ont d'abord été longtemps considérées comme intermédiaires entre les bactéries et les virus. Malgré leur caractère ténu, elles sont reconnues comme de véritables bactéries dans les années 1960[4].
Le séquençage du génome de Rickettsia prowazekii présente des similitudes avec l'ADN mitochondrial. Il est possible que les mitochondries proviennent, du point de vue évolutif, d'une association endosymbiotique avec un ancêtre de Rickettsia[2].
Pouvoir pathogène
Survie intracellulaire
Ces bactéries sont phagocytées par les macrophages, mais elles échappent à leur action (survie dans les phagocytes). Grâce à des facteurs de virulence, elles lysent le phagosome, ou s'en échappent avant que la membrane du phagosome ne se referme[5] et ne fusionne avec le lysosome[6]. Elles se retrouvent libres dans le cytoplasme (réserve de nutriments, pas de fusion avec lysosome sans membrane cellulaire...). Elles se multiplient par scissiparité (temps de génération de 8 à 10 heures).
Les Rickettsia du groupe typhus ne se multiplient que dans le cytoplasme[5]. Les Rickettsia du groupe boutonneux peuvent se multiplier aussi dans le noyau. Elles peuvent sortir de la cellule sans la lyser : la polymérisation d'actine permet de former des comètes ou queues, qui les rendent mobiles dans la cellule. Elles sont littéralement propulsées à la cellule adjacente[5]. La double membrane alors créé (évagination-invagination) subira le même sort que le phagosome et les bactéries seront à nouveau libres dans le cytoplasme.
Les rickettsies pénètrent ainsi à l’intérieur des cellules, des macrophages jusqu'aux cellules endothéliales des vaisseaux sanguins. Elles se multiplient alors dans ces cellules, qu’elles finissent par détruire.
Pathogénie
L’infection est multifocale. L’essaimage se fait par l’intermédiaire de cellules endothéliales parasitées, qui se détachent et circulent dans le sang. L’infection se répand dans de nombreux foyers, disséminés dans le corps. Les vaisseaux sanguins ne sont infectés que sur quelques segments, et pas sur toute leur longueur.
La souffrance de l’endothélium vasculaire provoque la coagulation du sang dans la lumière du vaisseau, et des petites hémorragies autour du vaisseau. Chaque foyer de multiplication bactérienne est entouré d’une réaction inflammatoire de type chronique, avec un infiltrat monocytaire et lymphocytaire.
Cette vascularite ou angéite disséminée explique les différentes manifestations au niveau de la peau (éruptions), cardiaques, musculaires, rénales et du système nerveux central.
Un déficit en glucose-6-phosphate déshydrogénase prédispose à l'apparition d'une rickettsiose sévère.
Epidémiologie
L'épidémiologie diffère selon les espèces de Rickettsia. Le point commun est toujours l'inoculation à l'homme par voie cutanée ou conjonctivale par un arthropode hématophage (pou, tique, puce...). Les rickettsies sont présentes dans les excréments et la salive de ces agents vecteurs, elles pénètrent l'hôte par les lésions cutanées, dont la piqûre du vecteur.
Les réservoirs importants sont représentés par les ongulés (chevreuil, le cerf et le sanglier...)[7] et les petits rongeurs.
Principales infections humaines
Le genre Rickettsia est responsables de deux groupes de maladies : le groupe typhus et le groupe des fièvres boutonneuses (spotted fevers en anglais). Depuis les années 1990, les nouvelles techniques moléculaires ont entrainé une refonte des classifications, et des agents nommés autrefois Rickettsia ont été classés dans d'autres tribus ou familles (Orientia, Ehrlichia, etc.)[8],[9] . Au début du XXIe siècle, les principales rickettsia sont donc, stricto sensu :
Groupe typhus
Il comprend le typhus historique, de répartition cosmopolite (saisons ou régions froides et d'altitude, avec manque d'hygiène). Le vecteur est un pou ou une puce.
Rickettsia prowazekii est responsable du typhus épidémique, dont le vecteur est le pou de corps de l'homme.
Rickettsia typhi est l'agent du typhus murin, dont le vecteur est la puce du rat.
Groupe des fièvres boutonneuses
Chacune est cantonnée dans une région géographique propre, avec quelques particularités cliniques. Le vecteur est une tique (active en saison chaude).
Rickettsia rickettsii est l'agent de la fièvre pourprée des montagnes Rocheuses, en Amérique du nord.
Rickettsia conorii est celui de la fièvre boutonneuse méditerranéenne, autour du bassin méditerranéen.
Rickettsia sibirica est l'agent de la fièvre de morsure de tique nord-asiatique[1].
Rickettsia akari est l'agent de la fièvre ou rickettsiose vésiculeuse (rickettsialpox en anglais). À la différence des précédentes, le vecteur n'est pas une tique mais un acarien, un pou de la souris.
Rickettsia felis est transmis par la puces du chat, Ctenocephalides felis. Décrite en 2002, on compte en tout, en 2017, moins de 100 cas publiés dans le monde. D'autres arthropodes vecteurs pourraient être impliqués, mais non démontrés à la même date[10].
L'écoépidémiologie des différences/similitudes géographiques n'est pas bien comprise. L'hypothèse dominante est la séparation des continents, avec séparation des espèces de mammifères, d'arthropodes et de rickettsies à laquelle se surajoutent les migrations humaines[8].
Diagnostic bactériologique
Le diagnostic est surtout clinique et épidémiologique.
Les rickettsies ne peuvent pas être cultivées sur milieu synthétique. Elles sont cultivées sur des cellules eucaryotes embryonnaires ou sur des animaux de laboratoire La culture à visée diagnostique n'est pas fiable et déconseillée à cause du risque de contaminations en laboratoire[1].
Le diagnostic peut être confirmé par la recherche d’anticorps dans le sérum des patients, le plus souvent par immunofluorescence indirecte. L'ancienne réaction d'agglutination de Weil-Felix n'est plus guère utilisée dans les pays développés. Ces anticorps n’apparaissent qu’avec retard sur les symptômes (selon les techniques et la maladie, de 5 à plus de 15 jours)[9].
La PCR est de plus en plus utilisée pour la mise en évidence de séquences d'ADN de l'agent infectieux[9].
Notes et références
- Frits H. Kayser, Manuel de poche de microbiologie médicale, Flammarion, Médecine-Sciences, (ISBN 978-2-2571-1335-1), p. 348-351.
- Prescott, Microbiologie, de boeck, (ISBN 978-2-8041-6012-8), p. 541-542.
- Prescott 2010, op. cit., p. 476.
- (en) Victoria A. Harden, Rickettsial Diseases, Cambridge University Press, (ISBN 0-521-33286-9), p. 981.dans The Cambridge World History of Human Disease, K.F. Kiple (dir.).
- Didier Musso et Didier Raoult, « Survie intracellulaire des micro-organismes », La Revue du Praticien, vol. 46, , p. 2160-2163
- Prescott 2010, op. cit., p. 832.
- Wodecka, B., Rymaszewska, A., & Skotarczak, B. (2013), Host and pathogen DNA identification in blood meals of nymphal Ixodes ricinus ticks from forest parks and rural forests of Poland. Experimental and Applied Acarology, 1-13 (résumé).
- D. Raoult, « Les nouvelles rickettsioses », Le Concours Médical, , p. 1069-1073.
- Jade Ghosn, « Rickettsioses », La Revue du Praticien, vol. 55, , p. 707-712.
- P. Parola, CMIT, Ricketssioses, Alinéa Plus, (ISBN 978-2-916641-66-9), p. 372.dans E. PILLY 2018, 26e édition.
Voir aussi
Articles connexes
Bibliographie
- D. H. Walker and D. B. Fishbein Epidemiology of rickettsial diseases European Journal of Epidemiology ; Volume 7, Number 3, 237-245, DOI: 10.1007/BF00145672 (Résumé))
- Mulenga, A., Macaluso, K. R., Simser, J. A., & Azad, A. F. (2003). Dynamics of Rickettsia–tick interactions: identification and characterization of differentially expressed mRNAs in uninfected and infected Dermacentor variabilis. Insect molecular biology, 12(2), 185-193 (résumé).
- Perlman S.J, Hunter M.S & Zchori-Fein E (2006) The emerging diversity of Rickettsia. Proceedings of the Royal Society of London B: Biological Sciences, 273(1598), 2097-2106.
Liens externes
- (en) Référence NCBI : Rickettsia
- (fr+en) Référence ITIS : Rickettsia da Rocha-Lima, 1916 ( )
- Portail de la microbiologie
- Portail de la médecine