Navette malate-aspartate
La navette malate-aspartate est un mécanisme de transport de molécules chez les eucaryotes à travers la membrane mitochondriale interne afin de transférer le NADH+H+ issu de la glycolyse produit dans le cytosol vers la matrice mitochondriale en régénérant du NAD+ dans le cytosol.
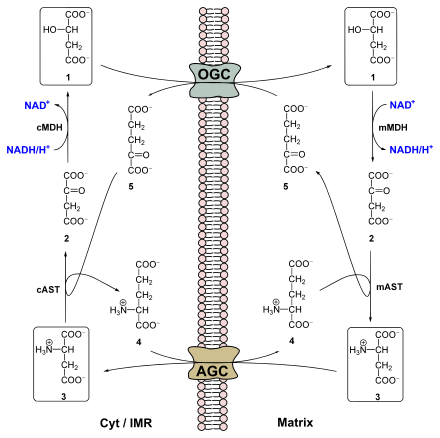
OGC : antiport malate-α-cétoglutarate ;
1 : malate ;
5 : α-cétoglutarate ;
MDH : malate déshydrogénase (c : cytosolique ; m : mitochondriale) ;
2 : oxaloacétate ;
AST : aspartate transaminase (c :cytosolique ; m : mitochondriale) ;
3 : aspartate ;
4 : glutamate ;
Matrix : matrice mitochondriale ;
AGC : antiport glutamate-aspartate ;
Cyt / IMR : cytosol / espace intermembranaire mitochondrial.
Fonctionnement
La membrane mitochondriale interne étant imperméable aux coenzymes telles que le NADH, celui traverse cette membrane de façon indirecte, à travers un échange de quatre métabolites rendu possible par un système de quatre enzymes — deux dans le cytosol et deux isoformes des précédentes dans la matrice mitochondriale — et deux antiports (perméases) de la membrane mitochondriale interne :
- le NADH transfère ses deux électrons à une molécule d'oxaloacétate cytosolique sous l'action d'une malate déshydrogénase du cytosol (cMDH) ;
- le malate cytosolique obtenu peut franchir la membrane mitochondriale externe à l'aide d'une porine mais doit emprunter un antiport malate-α-cétoglutarate pour franchir la membrane mitochondriale interne ;
- le malate parvenu dans la matrice mitochondriale est oxydé à nouveau en oxaloacétate par une malate déshydrogénase mitochondriale (mMDH) pour convertir une molécule de NAD+ en NADH ;
- l'oxaloacétate est converti en aspartate sous l'action d'une aspartate aminotransférase mitochondriale (mAST) par transfert d'un groupe amine du glutamate converti en α-cétoglutarate ;
- l'aspartate emprunte un antiport glutamate-aspartate pour franchir la membrane mitochondriale interne, puis franchit la membrane mitochondriale externe via une porine pour regagner le cytosol ;
- l'aspartate cytosolique est converti en oxaloacétate par une aspartate aminotransférase cytosolique (cAST) qui produit également du glutamate à partir de l'α-cétoglutarate.
Ce mécanisme présente l'avantage de préserver le potentiel de transfert des électrons produits par les oxydations cytosoliques, car ces électrons sont transférés indirectement d'un NADH cytosolique à un NADH mitochondrial.
Il ne s'agit donc pas d'un transport actif, de sorte qu'il n'est efficace que lorsque la concentration de NADH cytosolique est sensiblement plus élevée que celle de la matrice mitochondriale. Chez les mammifères, cette navette intervient essentiellement dans le cœur, le foie et les reins.
Les ions calcium Ca2+, messagers secondaires de la contraction musculaire, interviennent comme activateurs de cette navette[1].
Rôle métabolique
Il existe en revanche une autre navette mitochondriale, la navette du glycérol-3-phosphate, qui consomme une partie du potentiel de transfert des électrons du NADH cytosolique — elle est donc énergétiquement un peu moins efficace — mais est plus rapide et permet de libérer l'énergie plus tôt dans les organes qui en consomment beaucoup tels que les muscles et le cerveau.
La navette malate-aspartate permet de produire de l'ordre de 2,5 molécules d'ATP par NADH cytosolique, tandis que la navette du glycérol-3-phosphate permet de produire environ 1,5 molécules d'ATP par NADH cytosolique.
Notes et références
- Partie IV - Navettes mitochondriales – Chapitre 10 - La navette malate/aspartate sur le site consacré à la respiration mitochondriale (PDF) de la faculté de médecine de l'université Pierre-et-Marie-Curie à Paris.
- Mitochondrie sur le site du département des sciences biologiques de l'Université du Québec à Montréal.
- Portail de la biochimie