Hepcidine
L'hepcidine (de l'anglais : hepatic bacteriocidal protein) est une hormone peptidique sécrétée par le foie qui régule le métabolisme du fer dans l'organisme au niveau de l'absorption intestinale et de son stockage hépatique. Cette hormone a été impliquée dans le développement d'une maladie génétique de surcharge en fer, un type particulier d'hémochromatose appelé hémochromatose juvénile.
Historique de la découverte
La découverte de l'hepcidine a précédé celle de la reconnaissance de son rôle hormonal. Le peptide qui deviendra plus tard connu sous le nom d'hepcidine a été signalé pour la première fois comme un peptide antimicrobien synthétisé par le foie, semblable aux β-defensines [1],[2]. Par la suite, d'autres chercheurs ont découvert une augmentation de la production d'hepcidine chez la souris surchargée en fer[1].
Le rôle hormonal de l'hepcidine a été découvert par hasard, lors de recherches sur les gènes du métabolisme du glucose de la souris, faisant apparaitre la survenue d'une hémochromatose chez des souris à gènes inactivés (le gène de l'hepcidine est à proximité des gènes régulateurs du glucose)[1].
Pour le démontrer, des souris génétiquement modifiées ont été conçues pour surexprimer l'hepcidine (par copies supplémentaires du gène de l'hepcidine). Elles meurent après la naissance, avec de graves carences en fer, et guérissent par injection de fer, suggérant un rôle vital dans la régulation du métabolisme du fer[3],[4]. L'absence d'expression du gène de l'hepcidine entraine une hémochromatose, et sa surexpression une anémie hypochrome hyposidérémique[1].
La première preuve du rôle de l'hepcidine chez l'homme a été faite chez deux patients américains atteints de glycogénose avec anémie hypochrome hyposidérémique et adénome hépatique. L'anémie était réfractaire au traitement martial (supplémentation en fer). L'étude histologique des adénomes a montré une production excessive de l'ARN messager de l'hepcidine. Chez un patient, l'ablation chirurgicale de la tumeur a permis la guérison de l'anémie et la normalisation du fer sérique[1].
Plusieurs équipes ont mis en évidence, de façon concomitante, l'implication de l'hepcidine dans le développement d'une maladie génétique de surcharge en fer, l'hémochromatose juvénile[5],[6],[3],[7],[4],[8],[9].
Pris ensemble, ces découvertes ont suggéré que l'hepcidine régule la libération du fer dans l'organisme, en ayant une action « hyposidérémiante » (régulation négative)[1].
Structure
L'hepcidine est codée par le gène Hamp localisé sur le chromosome 19[10]. C'est un polypeptide composé de 25 acides aminés et qui présente quatre ponts disulfures intracaténaires.
Rôle dans la régulation du fer
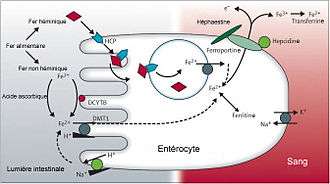
Le niveau de fer est constamment régulé suivant des mécanismes complexes, dont le centre de contrôle est l’hépatocyte, qui dispose de capteurs sensibles au niveau de fer : protéine de l'hémochromatose humaine (HFE), récepteur de la transferrine 2 (en) (dont le gène est TFR2), hémojuvéline 2 (en) (dont le gène est HJV ou HFE2). En réponse à un excès de fer circulant, l’hépatocyte produit l’hepcidine, régulant négativement le fer[11].
L’hepcidine induite par l’excès de fer bloque celui-ci dans les macrophages et les cellules intestinales, en se liant à la ferroportine et en l'internalisant à l'intérieur des cellules[12]. Il en résulte une rétention de fer à l'intérieur des cellules et une diminution du fer circulant au niveau du plasma. Au niveau des entérocytes, le fer ainsi fixé reste lié à la ferroportine et se retrouve excrété dans les fèces évitant ainsi une élévation de la sidérémie. A l’inverse, la diminution de fer circulant entraîne une diminution de l’hepcidine et la sortie du fer cellulaire. L'hepcidine et la ferroportine jouent donc un rôle important dans le métabolisme du fer[13].
Ce mécanisme régule la sidérémie pour répondre aux besoins de l’hématopoïèse.
Au total la production hépato-cellulaire d'hepcidine est régulée par des signaux provenant de l'inflammation, du statut en fer, de l'hématopoïèse, et de la tension en oxygène (hypoxie / anémie). Ces signaux peuvent être contradictoires (par exemple statut en fer excessif et¨hypoxie/anémie), dans ces cas les signaux de l'hématopoièse et de l'hypoxie/anémie prédominent sur ceux du statut en fer[1],[2].
Autres fonctions biologiques
L'hepcidine possède des fonctions antifongiques[14] et anti-bactériennes[15] d'où son nom. Toutefois, cette activité antimicrobienne nécessite, chez homme, des concentrations supérieures à celles qui existent normalement dans la circulation[2].
L'expression de l'hepcidine est augmentée par un signal inflammatoire l'interleukine 6 par l'intermédiaire du STAT3[16], ce qui explique en partie la baisse de fer associée à l'inflammation et à l'infection[2].
Les propriétés de l'hepcidine (diminution du fer sanguin) pourraient représenter une adaptation à la pression de sélection exercée par les micro-organismes (utilisation compétitive du fer), en limitant la disponibilité du fer circulant[2]. Lors d'une infection, le fer serait maintenu autant que possible intra-cellulaire pour le soustraire au métabolisme microbien[17].
Physiopathologie
L'hémochromatose juvénile peut être causée par des mutations du gène de l'hepcidine, mais dans la majorité des cas, l'hémochromatose juvénile est due à des mutations du gène codant la protéine hémojuveline, un régulateur hormonal de la production hepcidine.
L'inactivation du gène codant l'hepcidine entraîne une surcharge en fer. Par opposition, la surexpression entraîne une anémie (diminution du taux d'hémoglobine et du nombre de globules rouges).
Dans de nombreuses situations d'inflammation chronique (notamment certaines maladies auto-immunes), il existe une anémie avec hyposidérémie par production massive d'hepcidine, impliquant une cascade immunitaire via un fort taux d'interleukine 6 (rétrocontrôle positif de l'IL-6 sur l'hepcidine).
Dans le cas d'anémies avec hypersidérémie, le signal dominant est l'anémie, d'où inhibition de la production d'hepcidine avec augmentation de l'absorption digestive du fer. Ceci explique la surcharge en fer de certaines anémies comme les thalassémies, les érythoblastopénies, ou l'anémie de Fanconi[1].
Notes et références
- Axel Kahn, « Cibler l'hepcidine », Le Concours Médical, vol. 126, no 20, , p. 1119-1122.
- (en) Robert E. Fleming, « Iron Overload in Human Disease », The New England Journal of Medicine, vol. 366, no 4, , p. 348-357.
- Severe iron deficiency anemia in transgenic mice expressing liver hepcidin, Gaël Nicolas, Myriam Bennoun, Arlette Porteu, Sandrine Mativet, Carole Beaumont, Bernard Grandchamp, Mario Sirito, Michèle Sawadogo, Axel Kahn, and Sophie Vaulont. PNAS April 2, 2002;99(7):4596-4601
- Constitutive hepcidin expression prevents iron overload in a mouse model of hemochromatosis Gaël Nicolas, Lydie Viatte, Dan-Qing Lou, Myriam Bennoun, Carole Beaumont, Axel Kahn, Nancy C. Andrews & Sophie Vaulont. Nature Genetics;34,97-101 (2003)
- A New Mouse Liver-specific Gene, Encoding a Protein Homologous to Human Antimicrobial Peptide Hepcidin, Is Overexpressed during Iron Overload Christelle Pigeon, Gennady Ilyin, Brice Courselaud, Patricia Leroyer, Bruno Turlin, Pierre Brissot, and Olivier Loréal, J Biol Chem;March 16, 2001;276(11):7811-7819
- Lack of hepcidin gene expression and severe tissue iron overload in upstream stimulatory factor 2 (USF2) knockout mice, Gaël Nicolas, Myriam Bennoun, Isabelle Devaux, Carole Beaumont, Bernard Grandchamp, Axel Kahn, and Sophie Vaulont, PNAS, July 17, 2001;98(15):8780-8785
- The gene encoding the iron regulatory peptide hepcidin is regulated by anemia, hypoxia, and inflammation, Gaël Nicolas, Caroline Chauvet, Lydie Viatte, Jean Louis Danan, Xavier Bigard, Isabelle Devaux, Carole Beaumont, Axel Kahn and Sophie Vaulont. J Clin Invest,110:1037-1044 (2002).
- Functional differences between hepcidin 1 and 2 in transgenic mice, Dan-Qing Lou, Gaël Nicolas, Jeanne-Claire Lesbordes, Lydie Viatte, Gisèle Grimber, Marie-France Szajnert, Axel Kahn, and Sophie Vaulont. Blood;103(7), 2816-2821 (2004)
- Hepcidin, a candidate modifier of the hemochromatosis phenotype in mice, Gaël Nicolas, Nancy C. Andrews, Axel Kahn, and Sophie Vaulont.Blood;103(7), 2841-2843 (2004)
- (en) Gène HAMP sur la base de donnée OMIM
- (en) Enrico Rossi, « Hepcidin - the Iron Regulatory Hormone », Clin Biochem Rev., vol. 26, no 3, , p. 47–49 (lire en ligne).
- Nemeth E, Tuttle MS, Powelson J, Vaughn MB, Donovan A, Ward DM, Ganz T, Kaplan J, « Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization », Science, vol. 306, no 5704, , p. 2090–3 (PMID 15514116, DOI 10.1126/science.1104742)
- Thibaud Lefebvre, Sigismond Lasocki, Martine Fénéant-Thibault et Pierre-Jean Lamy, « Added value of hepcidin quantification for the diagnosis and follow-up of anemia-related diseases », Annales De Biologie Clinique, vol. 75, no 1, , p. 9–18 (ISSN 1950-6112, PMID 28132948, DOI 10.1684/abc.2016.1208, lire en ligne)
- (en) Christina H. Park, Erika V. Valore, Alan J. Waring and Tomas Ganz, « Hepcidin, a Urinary Antimicrobial Peptide Synthesized in the Liver », Journal of Biological Chemistry, vol. 276, , p. 7806-7810 (DOI 10.1074/jbc.M008922200, résumé).
- (en) Claudio A. Álvarez et al., « Antimicrobial activity of trout hepcidin », Fish & Shellfish Immunology, (DOI 10.1016/j.fsi.2014.04.013, résumé).
- Wrighting DM, Andrews NC, Interleukin-6 induces hepcidin expression through STAT3, Blood, 2006;108:3204–3209
- (en) Peter Gluckman, Principles of Evolutionary Medicine, Oxford University Press, (ISBN 978-0-19-923639-8), p. 223 et 273.
Articles connexes
- Protéine régulatrice du fer
- Élément de réponse au fer
- Fer sérique
- Hypersidérémie
- Hyposidérémie
- Sidéropénie
- Portail de la médecine
- Portail de la biochimie
- Portail de la physiologie