Echinococcus
Echinococcus (les échinocoques) est le nom donné à un genre de cestodes (vers endoparasites) responsables de zoonoses cosmopolites dont l'une est l'échinococcose alvéolaire, qui peut (rarement) toucher l'Homme, et que l'on ne savait autrefois pas soigner chez les patients ne guérissant pas spontanément. Plusieurs animaux domestiques ou d'élevages peuvent aussi être porteurs de ces cestodes.
| Règne | Animalia |
|---|---|
| Embranchement | Platyhelminthes |
| Classe | Cestoda |
| Sous-classe | Eucestoda |
| Ordre | Cyclophyllidea |
| Famille | Taeniidae |
Genre
Rudolphi, 1801
Depuis les années 1990, les progrès de la biologie moléculaire et de l'immunologie ont grandement amélioré la capacité à détecter et identifier ces parasites et ont « révélé des informations nouvelles sur la nature des réponses immunitaires générées au cours d'une infection hydatique, bien que de nombreux aspects de l'interaction Echinococcus-hôte restent (en 2012) inexplorés » [1].
Génétique
La taxonomie du genre Echinococcus est en cours de révision et a subi d'importants changements. Les Echinococcus granulosus paraphylétiques sont classés en plusieurs espèces distinctes[2].
Écologie et dynamique des populations
Tous les parasites doivent coévoluer avec leur hôte au cours de l'évolution, où l'un ou l'autre de ces eux acteurs disparait.
Comme de nombreux parasites les Echinococcus ont des compétences biologiques qui leur permettent de profiter de toute faiblesse immunitaire de l'hôte.
Une fois introduits dans l'organisme de leur hôte, les cestodes (E. granulosus en particulier) peuvent moduler[3] une partie de leur réponse immunitaire (humorale, cellulaire) et antiparasitaire[4]. L'échinocoque est toutefois plus ou moins bien adapté (selon son génome et selon les capacités de réponses de l'hôte ; un « immunopodulant » (polymère d'une lipoprotéine, antigène immunodéprimant) qui semble produit par le cestode a été identifié dans le fluide hydatique. Il s'agit d'un antigène B, de taille 120 kDa constitué de plusieurs sous-unités de 8 kDa environ[5] ; cette protéine semble inhiber l'activité élastase et perturber la chimiotaxie des globules blancs (neutrophiles), ce qui permet au parasite d'échapper au système immunitaire de son hôte (ce pourrait être une cible pour de nouveaux médicaments n'attaquant pas le parasite lui-même, mais ses moyens de défense, de manière à le rendre vulnérable aux globules blanc[5]).
Aux échelles biogéographiques, l'environnement écopaysager est également plus ou moins favorable aux parasitoses : les modifications du paysage induites par d'importants changements de pratiques agricoles, par la périurbanisation, la fragmentation routière, la fragmentation forestière notamment liées aux modifications de pratiques de gestion du gibier (agrainage, augmentation du nombre et des densités de sangliers et cervidés corrélativement à un recul des carnivores prédateurs), de la gestion sylvicoles forêt (équilibres sylvocynégétiques et des populations de rongeurs et d'herbivores) pourraient interagir avec la dynamique des échinocoques et d'autres parasites (tiques notamment, qui peuvent aussi affaiblir l'immunité des animaux qu'elles parasitent, par leurs propres moyens, ainsi que par les nombreux microbes parasites qu'elles peuvent injecter à leur hôte).
Les interactions hôte-parasite semblent varier selon les espèces, souches et génotypes au sein du genre Echinococcus. Elles sont encore mal comprises, mais des progrès importants ont été récemment faits[4] ; les études immunologiques faites in vitro et in vivo et les données de biologie moléculaire ou de l'immunoprotéomique ont confirmé que E. granulosus, comme le ténia humain et de nombreux autres parasites, peut interagir avec la réponse immunitaire humaine, dont lors de l'échinococcose kystique humaine[4].
Épidémiologie et écoépidémiologie
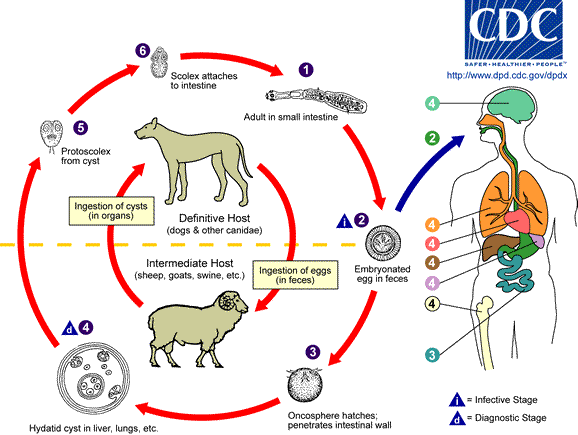
- E. multilocularis semble avoir récemment accru sa densité voire le nombre d'animaux hôtes infectés notamment dans le centre de l'Europe, avec une possible augmentation d'aire de répartition[2], dont chez des animaux domestiqués et domestiques qui pourraient aussi contribuer à leur diffusion[9]. Les taux de prévalence chez les renards (les mieux suivis) ont notamment augmenté dans de nombreux paysages à dominante agricoles en France, aux Pays-Bas en Allemagne, Autriche, Slovaquie et Pologne.
Ce parasite peut aussi accomplir son cycle de vie dans de nombreuses zones urbaines ou périurbaines, où les chiens, chats et parfois renards roux ont des densités de population élevées[2]. - E. granulosus s. s. (« souche ovine première ») pose encore de fréquents problèmes de santé publique dans le pourtour méditerranéen et des émergences ou réémergences sont observées ou suspectées (avec échecs de campagnes de lutte) en Bulgarie et même au Pays de Galles[2].
- Echinococcus ortleppi (qui peut concerner les bovins et les chevaux) est moins bien suivi, mais ces parasites semblent ne pas affecter l'Homme, de même probablement que les souches plus récemment (années 1990-2000) identifiées chez le porc et les cervidés[10],[11],[12],[13] (qui appartiennent toutes deux à un groupe de génotypes dont la taxonomie n'est pas encore résolue (Echinococcus sp.)[2]. La souche (génotype spécifique) trouvée chez les cervidés pourrait peut-être jouer un rôle dans les équilibres démographiques des populations loups - cervidés[11].
Liste des espèces (susceptible d'être prochainement révisée)
- Echinococcus granulosus (Batsch, 1786) (espèce qui semble présente dans le monde entier)
- Echinococcus multilocularis Leuckart, 1863 (Hémisphère nord)
- Echinococcus vogeli (Amérique centrale et du sud).
- Echinococcus oligarthrus (Amérique centrale et du sud).
Voir aussi
- Parasitose
- zoonose
- Cestode
- échinococcose
- épidémiologie
- écoépidémiologie
- Zootechnie
- Médecine vétérinaire
- Vermifuge
- Sérodiagnostic
Bibliographie
- Vuitton DA, Millon L, Gottstein B, Giraudoux P, « Proceedings of the international symposium — innovation for the management of echinococcosis. Besançon, March 27–29, 2014 », Parasite, vol. 21, , p. 28 (DOI 10.1051/parasite/2014024, lire en ligne)
- (en) Ortona E, Riganò R, Buttari B, Delunardo F, Ioppolo S, Margutti P, Profumo E, Teggi A, Vaccari S, Siracusano A., An update on immunodiagnosis of cystic echinococcosis ; Acta Trop. 2003 Feb;85(2):165-71. Review (résumé).
- (en) Wenbao Zhang, Hao Wen, Jun Li, Renyong Lin, and Donald P. McManus, Immunology and Immunodiagnosis of Cystic Echinococcosis: An Update. Clinical and Developmental Immunology, 2012, 10 pages doi:10.1155/2012/101895 (résumé)
Liens externes
- (en) Référence Fauna Europaea : Echinococcus
- (en) Référence Animal Diversity Web : Echinococcus
- (en) Référence NCBI : Echinococcus
- (en) Référence BioLib : Echinococcus Rudolphi, 1801
Notes et références
- Wenbao Zhang, Hao Wen, Jun Li, Renyong Lin, and Donald P. McManus, Immunology and Immunodiagnosis of Cystic Echinococcosis: An Update. Clinical and Developmental Immunology, 2012, 10 pages doi:10.1155/2012/101895 (résumé)
- Romig T, Dinkel A, Mackenstedt U., The present situation of echinococcosis in Europe ; Parasitol Int. 2006;55 Suppl:S187-91. Epub 2005 Dec 13 (Résumé)
- Siracusano A, Delunardo F, Teggi A, Ortona E, Cystic echinococcosis: aspects of immune response, immunopathogenesis and immune evasion from the human host ; Endocr Metab Immune Disord Drug Targets. 2012 Mar; 12(1):16-23.
- Siracusano A, Delunardo F, Teggi A, Ortona E., Host-parasite relationship in cystic echinococcosis: an evolving story ; Clin Dev Immunol. 2012; 2012:639362. Epub 2011 Oct 31 (résumé)
- Siracusano A, Margutti P, Delunardo F, Profumo E, Riganò R, Buttari B, Teggi A, Ortona E., Molecular cross-talk in host-parasite relationships: the intriguing immunomodulatory role of Echinococcus antigen B in cystic echinococcosis ; Int J Parasitol. 2008 Oct; 38(12):1371-6. Epub 2008 Jul 23.
- Blutke A, Hamel D, Hüttner M, Gehlen H, Romig T, Pfister K, Hermanns W., Cystic echinococcosis due to Echinococcus equinus in a horse from southern Germany ; J Vet Diagn Invest. 2010 May;22(3):458-62 ; (résumé)
- Hatch C. Echinococcus granulosus equinus in Irish dogs; Vet Rec. 1970 May 23;86(21):632-3.
- Varcasia A, Garippa G, Pipia AP, Scala A, Brianti E, Giannetto S, Battelli G, Poglayen G, Micagni G., Cystic echinococcosis in equids in Italy ; Parasitol Res. 2008 Mar;102(4):815-8. Epub 2008 Jan 6. (résumé)
- Boufana B, Stidworthy MF, Bell S, Chantrey J, Masters N, Unwin S, Wood R, Lawrence RP, Potter A, McGarry J, Redrobe S, Killick R, Foster AP, Mitchell S, Greenwood AG, Sako Y, Nakao M, Ito A, Wyatt K, Lord B, Craig PS., Echinococcus and Taenia spp. from captive mammals in the United Kingdom ; Vet Parasitol. 2012 Nov 23;190(1-2):95-103. doi: 10.1016/j.vetpar.2012.05.023. Epub 2012 Jun 1.
- Bowles J, Blair D, McManus DP., Molecular genetic characterization of the cervid strain ('northern form') of Echinococcus granulosus ; Parasitology. 1994 Aug; 109 ( Pt 2):215-21.
- Lavikainen A, Lehtinen MJ, Laaksonen S, Agren E, Oksanen A, Meri S., Molecular characterization of Echinococcus isolates of cervid origin from Finland and Sweden ; Parasitology. 2006 Nov;133(Pt 5):565-70. Epub 2006 Jul 11. (résumé)
- Lavikainen A, Lehtinen MJ, Meri T, Hirvelä-Koski V, Meri S., Molecular genetic characterization of the Fennoscandian cervid strain, a new genotypic group (G10) of Echinococcus granulosus. Parasitology. 2003 Sep; 127(Pt 3):207-15.
- Bowles J, Blair D, McManus DP, Molecular genetic characterization of the cervid strain ('northern form') of Echinococcus granulosus ; Parasitology ; Aout 1994 109 ( Pt 2):215-21.
- Portail de la parasitologie
