Composé organobromé
Les composés organobromés sont des composés organiques qui contiennent au moins une liaison d'un atome de carbone à un de brome (liaison carbone-brome) et plus généralement des composés organiques intégrant au moins un atome de brome qu'il soit lié au carbone ou à l'oxygène (esters de bromate, par ex), au soufre, à l'azote (N-bromosuccinimide), au phosphore, etc. Le plus répandu des organobromés est le bromométhane produit naturellement. De nombreux autres composés organobromés se trouvent dans la nature mais aucun n'est nécessaire aux mammifères qui n'en synthétisent pas non plus. Une application industrielle importante de ce type de composés est l'utilisation de polybromodiphényléthers comme ignifuges, retardateurs de flamme. Cependant les impacts sur l'environnement de plusieurs composés organobromés sont surveillés de manière de plus en plus scrupuleuse.
Propriété générale
La plupart des composés organobromés, comme la plupart des composés organohalogénés, sont relativement polaires. Le brome est plus électronégatif que le carbone (2,8 vs 2,5). Par conséquent, le carbone dans une liaison carbone-brome est électrophile. Ainsi les bromures d'alkyle sont des agents alkylants.
Les forces de liaison carbone-halogène ou les énergies de dissociation sont de 115, 83,7, 72,1, et 57,6 kcal/mol pour lié au fluor, au chlore, au brome ou à l'iode, respectivement[1].
Les réactivités des composés organobromés se ressemblent et sont intermédiaires entre les réactivités des composés organochlorés et organoiodés. Dans de nombreuses applications, les bromures organiques constituent un compromis de réactivité et de coût. Les principales réactions des composés organobromés sont les déshydrobromations (déshydrohalogénation), les réactions de Grignard, les réactions de Wurtz (couplage réductif) et des substitutions nucléophiles.
Synthèse
À partir du brome
Les alcènes réagissent facilement avec le brome, Br2 et sans catalyseur pour donner des dibromures vicinaux
- RCH=CH2 + Br2 → RCHBrCH2Br
Les composés aromatiques peuvent être aussi bromés avec du brome (production conjointe de bromure d'hydrogène, HBr). Des catalyseurs comme le tribromure d'aluminium, AlBr3 ou de fer, FeBr3 sont nécessaires pour cette réaction ait lieu. Les catalyseurs chlorés correspondants (AlCl3,FeCl3) peuvent être aussi utilisés mais le rendement baisserait légèrement tandis que l'interhalogène BrCl apparaîtrait. Les mécanismes de cette réaction suit les schémas habituels de substitution aromatique nucléophile :
- RC6H5 + Br2 → RC6H4Br + HBr
Une application importante de cette réaction est la production de tétrabromobisphénol-A (en)à partir du bisphénol A.
Des réactions de substitution radicalaire avec le brome aussi dite bromation radicalaire sont aussi communément employées pour préparer des composés organobromés. Les substrats carbonylés, benzyliques et allyliques sont particulièrement sujets à ce type de réactions. Par exemple, l'acide bromoacétique, CH3BrCOOH qui est commercialement significatif, est généré directement à partir de l'acide acétique et du brome en présence catalytique de tribromure de phosphore, PBr3:
- CH3CO2H + Br2 → BrCH2CO2H + HBr
Le brome convertit aussi le fluoroforme en bromotrifluorométhane.
À partir du bromure d'hydrogène
Le bromure d'hydrogène, HBr s'additionne sur les doubles liaisons pour donner des bromures d'alkyle, suivant la règle de Markovnikov:
- RCH=CH2 + HBr → RCHBrCH3
Sous des conditions de radicaux libres, la direction de cette addition peut être inversée. L'addition de radicaux libres est utilisée dans le commerce pour la synthèse des 1-bromoalcanes qui sont importants dans la formation d'amine tertiaires et de sels d'ammonium quaternaire. Le (2-bromoéthyl)benzène, C6H5CH2CH2Br et qui est un précurseur du styrène est produit par cette voie.
Le bromure d'hydrogène peut également être utilisé pour convertir des alcools en bromures d'alkyle. Cette réaction qui doit être effectué à basse température, est utilisée dans la synthèse industrielle de bromure d'allyle:
- HOCH2CH=CH2 + HBr → BrCH2CH=CH2 + H2O
Le bromure de méthyle, un fumigant, est généré à partir de méthanol, CH3OH et de bromure d'hydrogène.
À partir de sels de bromure
Les ions bromure, tels que fournis par des sels tel que le bromure de sodium, NaBr régissent comme nucléophile dans la formation de composés organobromés par métathèse[2].
Un exemple de bromation par métathèse via un sel de bromure est l'utilisation de bromure de cuivre(II) sur les cétones[3],[4]:
- R-CO-CH2-R' + CuBr2 → R-CO-CHBr-R' + CuBr
Composé organobromé industriellement important
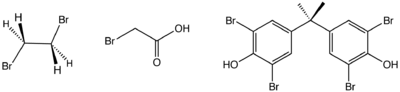 Structure de trois composés organobromés d'importance industrielle. De gauche à droite :bromure d'éthylène, acide bromoacétique et tétrabromobisphénol-A.
Structure de trois composés organobromés d'importance industrielle. De gauche à droite :bromure d'éthylène, acide bromoacétique et tétrabromobisphénol-A.
Ignifuge
Des composés organobromés sont largement utilisés comme retardateur de flamme[5], le principal étant le tétrabromobisphénol-A (4,4′-isopropylidènebis(2,6-dibromophénol, voir image ci-contre). Celui-ci et son anhydride tétrabromophtalique sont les précurseurs de polymères dont le squelette carboné contiennent obligatoirement des liaisons covalentes carbone-brome. D'autres retardants comme l'hexabromocyclododécane et les éthers de bromodiphényle sont des additifs qui ne sont pas liés chimiquement à la matière qu'ils protègent. L'utilisation de produits ignifuges organobromés est en croissance, mais est également controversée car ce sont des polluants persistants.
Fumigène et biocide
Le bromure d'éthylène, obtenu par addition de brome à l'éthylène, a été pendant quelques décennies un composant d'importance commerciale dans l'essence au plomb. Il était aussi un fumigant populaire dans l'agriculture, en remplacement du 1,2-dibromo-3-chloropropane ou DBCB, CH2Br–CHBr–CH2Cl. Ses deux applications sont, dans les années 2010, en déclin en raison de considérations environnementales et sanitaires. Le bromure de méthyle est un fumigant également efficace, mais sa production et son utilisation sont réglementées par le Protocole de Montréal. Durant cette période, c'est l'utilisation d'organobromés comme biocides dans le traitement de l'eau qui augmentent, par exemple pour le bromoforme, CHBr3 et la dibromodiméthylhydantoïne ou DBDMH[5]. Certains herbicides comme le bromoxynil, sont également des organobromés. Comme d'autres pesticides halogénés,le bromoxynil subit, en condition anaérobie, une déshalogénation réductrice (en) et peut être aussi débromé par des organismes vivants initialement caractérisés par leur capacité à déchlorer réductivement des composés phénoliques[6].
Colorant et teinture
De nombreux colorants contiennent des liaisons carbone-brome. Le produit naturel pourpre de Tyr (6,6'-dibromoindigo), était un colorant de valeur avant le développement de l'industrie des colorants de synthèse à la fin du XIXe siècle. Plusieurs dérivés bromés de l'anthraquinone sont utilisés commercialement. Le bleu de bromothymol est un indicateur coloré bien connu en chimie analytique.
Médicaments
Des composés pharmaceutiques organobromés disponibles commercialement comprennent la nicergoline, un vasodilatateur, le brotizolam, un sédatif, le pipobroman, un anti-tumoral, et la merbromine (Mercurochrome), un antiseptique. Cependant les composés organobromés sont rarement pharmaceutiquement utiles, contrairement aux composés organofluorés. Plusieurs médicaments sont produits sous forme de sels de bromure ou de bromhydrates et dans ce cas les contre-ions bromures sont inoffensifs, sans importance biologique[5].
Nouveau produit de synthèse
Des organobromés comme la 4-bromomethcathinone sont apparus sur le marché des nouveaux produits de synthèse (Designer Drugs) aux côtés d'autres amphétamines et cathinones halogénées, mises au point dans le but de circonvenir les lois anti-drogues.
Composé organobromé naturel
Les composés organobromés sont les organohalogénures les plus répandus dans la nature. Même si la concentration en bromure dans l'eau de mer n'est que 0,3 % celle de chlorure , les composés organobromés sont plus fréquents dans les organismes marins que les dérivés organochlorés. Cette abondance reflète l'oxydation facile des bromures organiques en l'équivalent d'ions bromures Br+, un bon électrophile. L'enzyme bromoperoxidase catalyse cette réaction[7]. Les océans sont estimés libérer un à deux millions de tonnes de bromoforme et environ 56 000 tonnes de bromométhane par an[8]. Les algues rouges comme la comestible Asparagopsis taxiformis ("limu kohu" hawaïen) concentrent les composés organobromés et organoiodés dans des cellules vésiculaires; 95 % de l'huile essentielle volatile d'Asparagopsis, préparée par séchage de l'algue sous vide et recondensation à température de la carboglace, est constitué de composés organohalogénés dont le bromoforme constitue 80 % de la masse[9]. Le bromoforme qui est produit par de nombreuses algues, est une toxine connue même si les petites quantités présentes dans un plat d'algues ne paraît pas poser de problème pour la santé humaine[10]. Certains de ces composés organobromés sont employés dans une forme de "guerre chimique" inter-espèce comme la 5-bromouracile et la 3-bromotyrosine qui ont été identifiées dans les globules blancs humains en tant que produits de l'halogénation induite par une myéloperoxydase sur les pathogènes envahissants[11].
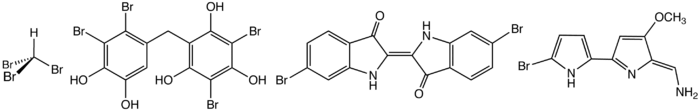 Structure de composés organobromés naturels. De gauche à droite : bromoforme, un bisphénol bromé, un dibromoindigo (pourpre de Tyr)et l'antiappétant tambjamine B.
Structure de composés organobromés naturels. De gauche à droite : bromoforme, un bisphénol bromé, un dibromoindigo (pourpre de Tyr)et l'antiappétant tambjamine B.
En plus des produits bromés naturels classiques, une variété de composés organobromés présents dans la nature résultent de la biodégradation des produits ignifuges. Les métabolites comprennent des bromures d'aryle méthylé ou hydroxylé ainsi que des dérivés de dioxine bromée. Ces composés sont considérés comme des polluants organiques persistants et ont été retrouvés chez les mammifères
Sécurité
Les composés bromures d'alkyles sont des agents alkylants et des dérivés aromatiques bromés sont impliqués en tant que perturbateurs endocriniens[12],[13]. Parmi les composés couramment produits, le dibromure d'éthylène est le plus préoccupant car il est à la fois très toxique et fortement cancérigène.
Notes et références
- S.J. Blanksby, G. B. Ellison, Bond dissociation energies of organic molecules, Acc. Chem. Res., 2003, vol. 36(4), pp. 255–263. DOI:10.1021/ar020230d, .
- James S. Nowick, Guido Lutterbach, Sodium Bromide, Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2001. DOI:10.1002/047084289X.rs054.
- L. Carroll King; and G. Kenneth Ostrum, « Selective Bromination with Copper(II) Bromide », The Journal of Organic Chemistry, vol. 29, no 12, , p. 3459–3461 (DOI 10.1021/jo01035a003)
- Dennis P. Bauer; and Roger S. Macomber, « Iodide catalysis of oxidations with dimethyl sulfoxide. Convenient two-step synthesis of .alpha. diketones from .alpha.-methylene ketones », The Journal of Organic Chemistry, vol. 40, no 13, , p. 1990-1992 (DOI 10.1021/jo00901a027)
- David Ioffe, Arieh Kampf Bromine, Organic Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, 2002. DOI: 10.1002/0471238961.0218151325150606.a01.
- A. M. Cupples, R. A. Sanford, G. K. Sims, Dehalogenation of Bromoxynil (3,5-Dibromo-4-Hydroxybenzonitrile) and Ioxynil (3,5-Diiodino-4-Hydroxybenzonitrile) by Desulfitobacterium chlororespirans, Appl. Env. Micro., 2005, vol. 71(7), pp. 3741-3746.
- Jayme N. Carter-Franklin, Alison Butler, Vanadium Bromoperoxidase-Catalyzed Biosynthesis of Halogenated Marine Natural Products, Journal of the American Chemical Society, 2004, vol. 126, pp. 15060-15066. DOI:10.1021/ja047925p.
- Gordon W. Gribble, The diversity of naturally occurring organobromine compounds, Chemical Society Reviews, 1999, vol. 28, pp. 335-346. DOI:10.1039/a900201d.
- Rhoda A. Marshall, John T.G. Hamilton, M.J. Dring, D.B. Harper, Do vesicle cells of the red alga Asparagopsis (Falkenbergia stage) play a role in bromocarbon production?, Chemosphere, 2003, 52, pp. 471–475.
- (en) Agency for Toxic substances and Disease Registry. Bromoform and Dibromochloromethane, 2005.
- Gordon W. Gribble, Naturally Occurring Organohalogen Compounds, Acc. Chem. Res., 1998, vol. 31(3), pp. 141–152. DOI:10.1021/ar9701777.
- Shigeyuki Kitamura, Teruhisa Kato, Mitsuru Iida, Norimasa Jinno, Tomoharu Suzuki, Shigeru Ohta, Nariaki Fujimoto, Hideki Hanada, Keiko Kashiwagi et Akihiko Kashiwagi, Anti-thyroid hormonal activity of tetrabromobisphenol A, a flame retardant, and related compounds: Affinity to the mammalian thyroid hormone receptor, and effect on tadpole metamorphosis, Life Sciences, 2005, vol. 76(14), pp. 1589-1601. DOI:10.1016/j.lfs.2004.08.030, Résumé.
- Shigeyuki Kitamura Norimasa Jinno, Shigeru Ohta, Hiroaki Kuroki and Nariaki Fujimoto, Thyroid hormonal activity of the flame retardants tetrabromobisphenol A and tetrachlorobisphenol A, Biochemical and Biophysical Research Communications, 2002, vol. 293(1), pp. 554-559. DOI:10.1016/S0006-291X(02)00262-0, Résumé.
Voir aussi
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | * | CLu | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn |
| Fr | CRa | * * |
Lr | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | ||||
| * * |
Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, mais pas d'usage courant | Liaison inconnue / non évaluée |
- Portail de la chimie