Borrelia garinii
Borrelia garinii est l'une des nombreuses espèces de borrélies (genre de bactéries spirochètes) qui peuvent infecter diverses espèces de vertébrés et d'invertébrés (tiques en particulier). Parmi les vertébrés, elle semble préférentiellement infecter les oiseaux, mais chez l'homme, elle est une des responsables possibles de la maladie de Lyme. Elle semble dans ce cas plutôt associée à des symptômes neurologiques.
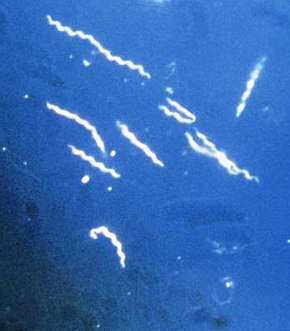
spirochète grossi 400 fois,
l'agent responsable de la maladie de Lyme
| Règne | Bacteria |
|---|---|
| Embranchement | Spirochaetes |
| Classe | Spirochaetes |
| Ordre | Spirochaetales |
| Famille | Spirochaetaceae |
| Genre | Borrelia |
Nom binominal
Baranton et al., 1992
Parmi une trentaine de borrélies connues, c'est l'une des quatre qui est susceptibles d'infecter l'Homme en provoquant une des variantes de la maladie de Lyme.
Son génome a été séquencé[1].
Il semble assez fréquent que des co-infections associent cette bactérie à une autre borrélie, voire à d'autres pathogènes véhiculés par le vecteur qui semble dans la plupart des cas être la tique Ixodes ricinus (en Europe), ce qui peut compliquer le diagnostic, et le traitement.
Définition, classification
Attention, l'expression « Borrelia burgdorferi » désigne parfois tout le complexe bactérien des borrélias (une trentaine de bactéries du genre Borrelia, dont quatre au moins sont pathogènes pour l'homme (et responsables de différentes formes de la maladie de Lyme). En théorie, pour éviter toute confusion, il faut dans ce cas parler de « Borrelia burgdorferi ls » (ls ou lato sensu signifiant « au sens large » en latin). Ceci est dû au fait que la première de ces bactéries découverte était B burgdorferi qui prédomine très largement aux États-Unis, alors que Borrelia afzelii prédomine en Asie, et semble localement fréquente en Europe de l'Ouest (dans la Meuse en France par exemple), au moins depuis deux décennies.
Dans ce complexe, outre B. garinii, trois espèces de borrélies pathogènes pour l'homme sont plus fréquentes :
- Borrelia afzelii qui, comme Borrelia garinii est prédominante en Eurasie ;
- Borrelia burgdorferi ss qui prédomine en Amérique du Nord, tout en étant également présente en Europe, bien que plus rare ;
- Borrelia spielmanii, absente en Amérique du nord, plus rare en Europe et fréquente en Asie est également impliquée dans la maladie de Lyme.
Toutes ces bactéries sont transmises à l'homme par l'intermédiaire de tiques vectrices de différentes espèces, mais on se demande si d'autres acariens ou insectes piqueurs ne pourraient pas également transmettre ces borrélies à l'Homme.
Un patient peut être piqué dans un pays, et déclarer la maladie, quelques semaines à plusieurs années après dans un autre pays, sur un autre continent.
Tolérance à l'oxygène ?
L'aérotolérance des borrélies varie selon l'espèce.
On a d'abord pensé que les Borrelia étaient des « anaérobies strictes », c'est-à-dire qu'elles ne peuvent se reproduire qu'en l'absence d'oxygène. On sait aujourd'hui que c'est faux, au moins en laboratoire ; en culture sur milieu modifié de Kelly-Pettenkofer ou Barbour-Stonner-Kelly-II dit « BSK-II ». Ainsi certaines souches de Borrelia garinii (tout comme certaines souches de B. afzelii) se développement en milieu aérobie légèrement enrichi de CO2 (3 %) bien qu'elles soient environ deux fois moins nombreuses à pouvoir le faire que les souches de Borrelia burgdorferi sensu stricto ayant en laboratoire démontré cette capacité (« aérotolérance »).
- Une étude (2006) a comparé la croissance de 29 souches d'origine « humaines » provenant de trois espèces (Borrelia burgdorferi sensu lato) pathogènes pour l'homme. Les 29 souches ont pu être cultivée avec succès en condition anaérobie. Seules 33 % des B. garinii et B. afzelii se sont reproduites en en aérobiose (avec 3 % de CO2), contre 75 % des souches de B. burgdorferi sensu stricto[2].
Diagnostic
Les éléments de diagnostic sont ceux de la maladie de Lyme.
L'érythème migrant, souvent associé à de la fièvre est typique, mais non systématique (il peut être très discret ou ne pas apparaître du tout ou avoir été confondu avec une allergie.). S'il n'a pas été détecté en phase initiale de la maladie, le malade peut spontanément guérir ou sa maladie va évoluer en deux phases successibles plus difficiles à soigner, avec le risque de conserver des séquelles invalidantes toute sa vie.
En son absence ou s'il n'a pas été détecté au premier stade de la maladie, et plus encore si le malade a oublié qu'il a été piqué ou ne pense pas à faire le rapprochement entre une piqure ancienne de tique et ses symptômes, le médecin doit détecter, via un diagnostic différentiel complexe, une association de symptôme, parmi une centaine de symptômes recensés, dont aucun n'est spécifique ni typique hormis l'ACA (Acrodermatite chronique atrophiante ; qui est typique mais n'est cependant pas systématique, et qui peut avoir disparu au moment du diagnostic ou peut être confondu avec une cicatrice de brûlure ou un lichen plan). L'ACA semble être une manifestation typique de cette bactérie ou de ses consœurs européennes, alors qu'il n'a jamais été détecté en Amérique du Nord.
Après la phase d'infection, lors de la phase chronique d'infection, la bactérie se multiplie peu, est capable d'échapper au système immunitaire (en distançant les globules blancs) ou en s'enkystant avant de créer un nouveau foyer d'infection dans un autre organe quelques mois ou années plus tard.
Test de dépistage et de confirmation (In vitro)
Le test de dépistage est souvent immunoenzymatique (méthode considérée comme plus fiable que les dépistages par immunofluorescence indirecte ou hémagglutination indirecte ; les deux dernières méthodes étant jugées d'interprétation plus subjective[3]). Le premier test est donc généralement un test Elisa (rapide et peu couteux), mais avec de faux-négatifs ou de faux-positifs possibles.
Le test de confirmation est le plus souvent un Western Blot, si possible effectué sur un sérum frais, sinon sur un plasma frais, clair et sans hémolyse.
Ce test est plus spécifique et sensible que les test de dépistages, mais plus long dans sa mise en œuvre. Si les bandelettes sont illisibles mais que les symptômes persistent, un second test doit être fait dans les semaines qui suivent.
Il existe depuis peu un Western Blot reconnaissant spécifiquement les protéines de B. Afzelli et B. garinii, qui sont les borrélies les plus fréquentes de l'Europe au Japon, alors que les premiers tests étaient faits pour détecter B. burgdorferi, qui n'est presque pas présent en Eurasie mais très présent aux États-Unis.
Théoriquement, les Western Blot aujourd'hui mis sur le marché doivent détecter des protéines communes aux quatre borrélies impliquée dans la maladie.
La notice de ce test précise cependant qu'« Une interprétation négative n'exclut pas la possibilité d'une infection à borrelia »[4]. Des faux positifs sont par ailleurs possibles si le malade a été infecté ou co-infecté par d'autres spirochètes (ex. : Syphilis, Pian, Pinta, Leptospirose, autres borrélioses, maladies parodontales…) ou à la suite d'autres infections telles que fièvre pourpre des Montagnes Rocheuses, virus d'Epstein-Barr ou cytomégalovirus dont les anticorps ont une réaction croisée avec B afzelii ou garinii. Des maladies autoimmunes des tissus conjonctifs comme la polyarthrite rhumatoïde ou certaines formes de lupus érythémateux peuvent aussi produire des faux positifs, comme d'ailleurs des sujets produisant des anticorps antinucléaires.
Une PCR (qui détecte l'ADN de la borrélie, après amplification de ce dernier et grâce à une « sonde » spécifique) est également possible (sur prélèvement de liquide cérébrospinal ou synovial en général). Enfin, une culture directe des spirochètes peut être faite.
Diagnostic différentiel
Il vise à vérifier qu'il ne s'agit pas d'un polyarthrite juvénile, d'un lupus, d'une sclérose en plaques, d'un rhumatisme articulaire aigu, d'un syndrome oculo-urétro-synovial, d'une myocardite ou d'une méningite virale, etc.
Notes et références
- Le génome de Borrelia Afzelli PKo Gemonme Page
- (en) De Martino SJ, Sordet C, Piémont Y, Ruzic-Sabljic E, Thaddée Vetter M, Monteil H, Sibilia J, Jaulhac B, « Enhanced culture of Borrelia garinii and Borrelia afzelii strains on a solid BSK-based medium in anaerobic conditions » Res Microbiol. 2006 Oct;157(8):726-9. (résumé)
- (en) Magnarelli, L.A. JF. Anderson, R.C. Johnson (1987) J. Infections Disease DIS 156. Vol. 11-183-187
- Exemple : paragraphe 14 de la notice du test 44-2020M (« Western Blot IgM EU-Lyme ; Test Western Blot pour détection des IgM dirigées contre Borrelia afzelii et Borrelia garinii. À usage professionnel exclusivement »), intitulé « limites de la procédure », alinéa D : « Une interprétation négative n'exclut pas la possibilité d'une infection à B. afzelli/garinnii »
Voir aussi
Articles connexes
Liens externes
- (en) Référence Catalogue of Life : Borrelia garinii Baranton et al. 1992
- (en) Référence NCBI : Borrelia garinii
(en)
- NCBI Taxonomy Browser - Borrelia
- Borrelia burgdoferi B31 Genome Page
- Borrelia Garinii PBi Genome Page
- Borrelia Afzelli PKo Genome Page
- Portail de la médecine
- Portail de la microbiologie