Acyl-coenzyme A déshydrogénase
Une acyl-CoA déshydrogénase est une déshydrogénase qui catalyse la première étape de la β-oxydation en introduisant une double liaison trans entre les atomes de carbone 2 et 3 de l'acyl-CoA par déshydrogénation à l'aide d'un cofacteur FAD[2] :
- Acyl-CoA + FAD → FADH2 + trans-2,3-déshydroacyl-CoA.
| Acyl-CoA déshydrogénase des acides gras à chaîne courte | ||
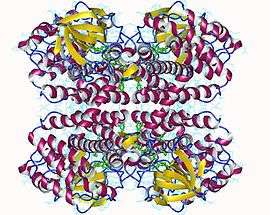 Tétramère d'acyl-CoA déshydrogénase des acides gras à chaîne courte humaine avec FAD en vert (PDB 2VIG) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | ACADS | |
| N° EC | 1.3.8.1 | |
| Homo sapiens | ||
| Locus | 12q24.31 | |
| Masse moléculaire | 44 297 Da[1] | |
| Nombre de résidus | 412 acides aminés[1] | |
| Acyl-CoA déshydrogénase des acides gras à chaîne moyenne | ||
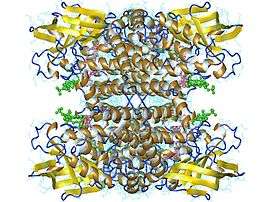 Tétramère d'acyl-Coa déshydrogénase des acides gras à chaîne moyenne humaine avec FAD en rose et octanoyl-CoA en vert (PDB 1EGC) | ||
| Caractéristiques générales | ||
| Symbole | ACADM | |
| N° EC | 1.3.8.7 | |
| Homo sapiens | ||
| Locus | 1p31.1 | |
| Masse moléculaire | 46 588 Da[1] | |
| Nombre de résidus | 421 acides aminés[1] | |
| Acyl-CoA déshydrogénase des acides gras à longue chaîne | ||
| Caractéristiques générales | ||
| Symbole | ACADL | |
| N° EC | 1.3.8.8 | |
| Homo sapiens | ||
| Locus | 2q34 | |
| Masse moléculaire | 47 656 Da[1] | |
| Nombre de résidus | 430 acides aminés[1] | |
| Acyl-CoA déshydrogénase des acides gras à très longue chaîne | ||
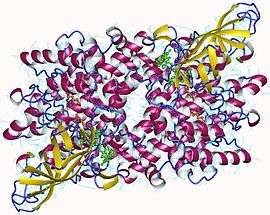 Dimère d'acyl-CoA déshydrogénase des acides gras à très longue chaîne humaine avec FAD en vert et palmiténoyl-CoA en orange (PDB 2UXW) | ||
| Caractéristiques générales | ||
| Symbole | ACADVL | |
| N° EC | 1.3.8.9 | |
| Homo sapiens | ||
| Locus | 17p13.1 | |
| Masse moléculaire | 70 390 Da[1] | |
| Nombre de résidus | 655 acides aminés[1] | |
Il existe diverses variétés de cette enzyme, chacune ayant une spécificité accrue pour certains types de substrats en fonction de la longueur de la chaîne aliphatique de l'acide gras. On distingue notamment les acyl-coenzyme A déshydrogénases des acides gras à chaîne courte, à chaîne moyenne, à longue chaîne et à très longue chaîne. Elles agissent toutes cependant de la même façon, les différences se situant principalement dans la localisation du site actif le long de la séquence d'acides aminés[3].
Ces enzymes jouent un rôle métabolique important chez les mammifères car elles permettent de démarrer l'oxydation les acides gras du régime alimentaire. Un déficit en acyl-CoA déshydrogénase est responsable de certaines maladies génétiques[4].
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | FAD |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | Structures |
| GO | AmiGO / EGO |
| N° EC | EC |
|---|
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | Structures |
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | FAD |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | Structures |
| N° EC | EC |
|---|---|
| Cofacteur(s) | FAD |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | Structures |
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) Colin Thorpe et Jung-Ja P. Kim, « Structure and mechanism of action of the acyl-CoA dehydrogenases », FASEB Journal, vol. 9, no 9, , p. 718-725 (lire en ligne)
- (en) J. J. Kim, M. Wang et R. Paschke, « Crystal structures of medium-chain acyl-CoA dehydrogenase from pig liver mitochondria with and without substrate », Proceedings of the National Academy of Sciences of the United States of America, vol. 90, no 16, , p. 7523-7527 (lire en ligne) DOI:10.1073/pnas.90.16.7523
- (en) E. H. Touma et C. Charpentier, « Medium chain acyl-CoA dehydrogenase deficiency », Archives of Disease in Childhood, vol. 67, no 1, , p. 142-145 (lire en ligne) DOI:10.1136/adc.67.1.142
Voir aussi
Articles connexes
- Déficit en acyl-coenzyme A déshydrogénase des acides gras à chaîne courte
- Déficit en acyl-coenzyme A déshydrogénase des acides gras à chaîne moyenne
- Déficit en 3-hydroxyacyl-coenzyme A déshydrogénase des acides gras à chaîne longue
- Déficit en acyl-coenzyme A déshydrogénase des acides gras à chaîne très longue
- Portail de la biochimie
