Acide dichloroacétique
L’acide dichloroacétique (ou acide dichloroéthanoïque) a la structure de l’acide acétique dans lequel on aurait remplacé deux des trois atomes d’hydrogène du groupe méthylique par des atomes de chlore (CHCl2COOH). Il est préparé par la réduction d'acide trichloracétique.
| Acide dichloroacétique | |||
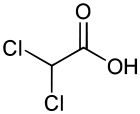 | |||
| Structure de l'acide dichloroacétique. | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Acide dichloroéthanoïque | ||
| No CAS | |||
| No ECHA | 100.001.098 | ||
| No EC | 201-207-0 | ||
| Apparence | liquide incolore, d'odeur âcre[1] | ||
| Propriétés chimiques | |||
| Formule brute | C2H2Cl2O2 [Isomères] |
||
| Masse molaire[2] | 128,942 ± 0,006 g/mol C 18,63 %, H 1,56 %, Cl 54,99 %, O 24,82 %, |
||
| pKa | 1,25 | ||
| Diamètre moléculaire | 0,539 nm [3] | ||
| Propriétés physiques | |||
| T° fusion | 13,5 °C[1] | ||
| T° ébullition | 194 °C[1] | ||
| Solubilité | dans l'eau : miscible | ||
| Paramètre de solubilité δ | 22,5 MPa1/2 (25 °C)[4]; 26,3 J1/2·cm-3/2 (25 °C)[3] |
||
| Masse volumique | 1,56 g·cm-3[1] | ||
| Pression de vapeur saturante | à 20 °C : 19 Pa[1] | ||
| Thermochimie | |||
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction | 1,4658 [3] | ||
| Précautions | |||
| SGH[6] | |||
  Danger |
|||
| SIMDUT[7] | |||
  D1B, D2A, E, |
|||
| Transport | |||
| Classification du CIRC | |||
| Groupe 2B : Peut-être cancérogène pour l'homme[8] | |||
| Écotoxicologie | |||
| LogP | 0,92[1] | ||
| Seuil de l’odorat | bas : 0,04 ppm[9] | ||
| Composés apparentés | |||
| Autres composés |
Dalapon (acide dichloro-2,2 propanoique) |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Chimie
La chimie de l'acide dichloroacétique est étroitement liée à celle des acides organiques halogénés. C'est un membre de la famille des acides chloroacétiques. L'ion dichloroacétate est produit dès la dissolution dans l'eau. Il s'agit d'un acide faible avec un pKa de 1,3, et qui est très corrosif et extrêmement destructeur des tissus des muqueuses et des voies respiratoires supérieures.
Usage thérapeutique
Acidose lactique
L’ion dichloroacétate stimule l'activité de l'enzyme pyruvate déshydrogénase en inhibant l'enzyme kinase de déshydrogénase de pyruvate. Ainsi, il diminue la production de lactate en décalant le métabolisme du pyruvate de glycolyse vers l'oxydation dans les mitochondries. Cette propriété a été employée pour traiter l’acidose lactique chez les humains.
Cancer
Dans des expériences réalisées en janvier 2007 à l’université d'Alberta, le dichloroacétate a été utilisé pour régler et reconstituer des fonctions métaboliques normales dans des mitochondries endormies par le cancer[10]. Ceci est particulièrement intéressant dans les cellules cancéreuses, qui ne se détruisent pas par elles-mêmes (apoptose) dues aux fonctions métaboliques endommagées. Des doses minimes de dichloroacétate ont réduit des cancers du sein, des tumeurs cérébrales, et des cancers du poumon lors d'essais sur des cellules humaines et chez le rat.
Bien que ceci indique que l'acide dichloroacétique pourrait éventuellement être employé en thérapie humaine contre le cancer, aucune étude clinique à grande échelle n'a été réalisée. Cependant, suivant une étude sur des animaux, une étude clinique financée par des fonds privés (1.5 millions de dollars) fut réalisée sur 5 patients. Notons cependant que cette étude fut réalisée sans placébo. Cette équipe de chercheurs, était sous la responsabilité du Dr Evangelos Michelakis. Leurs travaux ont été publiés dans la revue "Cancer Cell" en janvier 2007[11] et dans le "Science Translational Medicine" août 2010. Il semblerait que ce traitement ait augmenté l'espérance de vie de ces patients. Notons aussi que la société canadienne du cancer déconseille vivement l'automédication, étant donné le peu d'information concrète encore disponible et surtout, de la toxicité potentielle dépendante du dosage.
Effets secondaires
L’utilisation thérapeutique du dichloroacétate peut causer des douleurs, des engourdissements et perturber la marche.
Le dichloroacétate peut également avoir des effets anxiolytiques ou sédatifs.
Références
- ACIDE DICHLOROACETIQUE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Acide dichloroacétique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme », sur http://monographs.iarc.fr, CIRC, (consulté le 22 août 2009)
- « Dichloroacetic acid », sur hazmap.nlm.nih.gov (consulté le 14 novembre 2009)
- (en) Sébastien Bonnet, Stephen L. Archer, Joan Allalunis-Turner, Alois Haromy, Christian Beaulieu, Richard Thompson, Christopher T. Lee, Gary D. Lopaschuk et Lakshmi Puttagunta, « A Mitochondria-K+ Channel Axis Is Suppressed in Cancer and Its Normalization Promotes Apoptosis and Inhibits Cancer Growth », Cancer Cell, vol. 11, no 1, , p. 37–51 (PMID 17222789, DOI 10.1016/j.ccr.2006.10.020)
- Bonnet, Sébastien et al. « A Mitochondria-K+ Channel Axis Is Suppressed in Cancer and Its Normalization Promotes Apoptosis and Inhibits Cancer Growth ». Cancer Cell 11.1 (2007): 37‑51. ScienceDirect. Web. 6 juill. 2014.
Liens externes
- Portail de la chimie