Traduction génétique
En biologie moléculaire, la traduction génétique est l'étape de synthèse des protéines par les ribosomes, à partir de l'information génétique contenue dans les ARN messagers[1],[2]. Le ribosome interprète l'information contenue dans l'ARNm sous forme de codons ou triplets de nucléotides, qu'il traduit en acides aminés assemblés dans la protéine, selon l'ordre donné par les codons portés par l'ARNm. La table de correspondance entre codons et acides aminés permettant cette traduction s'appelle le code génétique.

La traduction des ARNm en protéine s'effectue dans le cytoplasme des cellules. Le ribosome est le cœur de la machinerie de synthèse des protéines cellulaires[3]. Chez toutes les espèces vivantes, il est constitué de deux sous-unités qui jouent des rôles distincts et complémentaires. La petite sous-unité assure la lecture des codons sur l'ARN messager, tandis que la grande sous-unité catalyse la synthèse des liaisons peptidiques entre les acides aminés successifs de la protéine. Le processus central progresse de manière cyclique le long d'un brin d'ARN (ARNm) :
- Un complexe ternaire ARNt porteur d'un acide aminé et d'un GTP, se présente sur la petite unité.
- Si l'anti-codon correspond au premier triplet aval libre du brin transcrit, l'ensemble est accepté par la petite unité. Le GTP est hydrolysé et se dissocie, et l’ARNt porteur de l'acide aminé peut pénétrer dans le site d'arrivée (étape d’accommodation).
- La grande sous-unité libère l'ARNt précédent de l'amorce de protéine qu'il portait, et catalyse une liaison peptidique entre cet acide aminé et la protéine en formation, rajoutant une unité au polypeptide en formation (étape de transpeptidation).
- Un mouvement de cliquet spontané entre ses deux sous-unités décale les ARNt portés par la petite sous-unité par rapport à la grande, ce qui permet la libération de l'ARNt précédent, à présent débarrassé de son polypeptide, et un cliquet en sens inverse de la petite sous-unité (étape de translocation).
Outre les ribosomes qui assurent ainsi la synthèse protéique et le décodage de l'ARNm, la traduction nécessite des acides aminés apportés par des ARNt, des protéines spécifiques appelées facteurs de traduction qui assistent les différentes étapes du processus, et de l'énergie sous forme de guanosine triphosphate (GTP).
Processus
On peut diviser la traduction en trois phases principales[4] : le démarrage qui consiste au recrutement du ribosome sur l'ARNm et à la reconnaissance du premier codon ou codon d'initiation ; l'élongation, c'est-à-dire la synthèse proprement dite de la protéine par le ribosome à partir de la séquence des codons ; la terminaison qui se produit lorsque le ribosome arrive sur le codon-stop et qui permet la libération de la chaîne protéique terminée et le recyclage des sous-unités du ribosome.
Démarrage (initiation)
Le démarrage de la traduction consiste en le recrutement du ribosome sur le premier codon de la séquence codant la protéine sur l'ARN messager. Cette étape implique une seule des deux sous-unités du ribosome qui doivent être au préalable dissociées. C'est la petite sous-unité du ribosome (30S chez les procaryotes ou 40S chez les eucaryotes) qui se lie ainsi en premier à l'ARN messager, pour aboutir à l'interaction entre le codon de démarrage et l'anticodon d'un ARNt spécifique appelé ARNt initiateur ou ARNt de démarrage. Cet ARNt a un anticodon complémentaire du codon de démarrage AUG et porte le premier acide aminé qui sera incorporé dans la protéine, une méthionine. Dans tous les cas, c'est l'interaction entre l'anticodon de l'ARNt de démarrage et le codon d'initiation qui constitue l'événement déclencheur du démarrage de la traduction. Il y a alors hydrolyse d'une molécule de GTP associée à un facteur spécifique lié à l'ARNt de démarrage : le facteur IF2 (bactéries) ou eIF2 (eucaryotes). Ceci déclenche la dissociation de ces différents facteurs de démarrage et le recrutement de la grande sous-unité ribosomique (50S chez les procaryotes ou 60S chez les eucaryotes).
Le démarrage de la traduction est une étape essentielle de l'expression des gènes, car c'est à ce niveau que s'exercent de nombreuses régulations. En jouant sur l'efficacité du ribosome sur le codon de démarrage, la cellule peut moduler la quantité de protéine produite à partir d'un ARNm donné[5],[6]. C'est le principe de base de la régulation traductionnelle.
Les détails du mécanisme de démarrage de la traduction sont différents chez les eucaryotes et chez les bactéries.
Bactéries
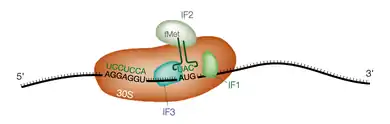
Chez les bactéries, la reconnaissance du codon de démarrage se fait grâce à l'interaction entre l'extrémité 3' de l'ARN ribosomique 16S et une séquence spécifique complémentaire située sur l'ARN messager juste en amont et appelée séquence Shine-Dalgarno[7]. Cette séquence a pour consensus AGGAGGUAA et est située 6 à 12 nucléotides en amont du codon de démarrage AUG. Ceci permet le recrutement du ribosome sur des codons de démarrage internes de l'ARNm, en particulier dans les ARN polycistroniques.
D'autre part la première méthionine portée par l'ARNt de démarrage est formylée sur sa fonction amine. Le premier acide aminé incorporé est donc une N-formylméthionine. Le recrutement de ce premier ARNt nécessite l'intervention de trois facteurs de démarrage ou facteurs d'initiation, appelés IF1, IF2 et IF3.
IF1 se fixe dans le site A de la sous-unité 30S du ribosome et permet le recrutement direct de l'ARNt de démarrage au site P. IF2 complexé au GTP interagit directement avec l'ARNt de démarrage. IF3 assure la dissociation préalable des sous-unités 30S et 50S et vérifie que l'interaction entre le codon de démarrage AUG et l'anticodon de l'ARNt est correcte. Lorsque le complexe ternaire ARNm/ARNt/ribosome est formé, le GTP lié à IF2 est hydrolysé, la grande sous-unité 50S est recrutée à son tour et les facteurs d'initiation quittent le complexe.
Ce mécanisme de recrutement via la séquence Shine-Dalgarno permet une entrée interne directe du ribosome sur le cistron de l'ARNm. Ceci permet la traduction des différents cistrons présents sur des ARNm polycistroniques, ce qui n'est pas possible avec le mécanisme de scanning des eucaryotes.
Eucaryotes

Chez les eucaryotes, le principal mécanisme de reconnaissance du codon de démarrage est l'initiation par balayage ou scanning à partir de l'extrémité 5' de l'ARNm. Les ARNm cytoplasmiques matures sont organisés sous forme de pseudo-cercles : leur extrémité 5' est modifiée par une coiffe qui lie le facteur de démarrage eIF4E et leur extrémité 3'polyadénylée fixe la PABP (poly(A)-binding protein). Ces deux facteurs eIF4E et PABP interagissent avec eIF4G, pour former le pseudo-cercle[8]. Lorsque l'ARNm est ainsi circularisé, eIF4G recrute un complexe, nommé complexe de préinitiation 43S, constitué de la petite sous-unité du ribosome 40S, de l'ARNt de démarrage et des facteurs d'initiation eIF1, eIF1A et eIF3. Cet assemblage constitue le complexe 48S qui va ensuite glisser à partir de l'extrémité 5' de l'ARNm jusqu'à rencontrer le premier codon de démarrage AUG. Ce mécanisme nécessite l'intervention de facteurs d'initiation additionnels : eIF2, eIF3, eIF5A eIF5B[9].
L'intérêt de ce mécanisme de circularisation de l'ARNm, préalable au recrutement du ribosome, est d'introduire une étape de contrôle qualité de l'ARNm. Seuls les ARNm pourvus d'une coiffe en 5' et d'une queue poly(A) en 3' sont traduits, les ARNm incomplets ou clivés ne peuvent pas recruter de ribosome, ce qui évite la production de protéines anormales (voir aussi plus bas la section "contrôle qualité").
La reconnaissance du codon AUG de démarrage s'effectue par un balayage du complexe 48S de 5' vers 3', à partir de la coiffe. En général, c'est le premier triplet AUG rencontré qui est utilisé pour démarrer la traduction. C'est l'interaction de ce codon AUG avec l'anticodon de l'ARNt présent dans le complexe 48S qui permet le calage du ribosome sur le début de la séquence codante. L'interaction est favorisée par la présence d'un contexte de séquence favorable autour du codon AUG, appelé séquence de Kozak[10].
La séquence consensus de Kozak chez les vertébrés est gccRccATGG, où R désigne une purine.
En plus de ce mécanisme général de démarrage chez les eucaryotes, il existe deux voies alternatives plus rares que l'on retrouve en particulier dans les systèmes viraux : le démarrage interne par IRES et le shunt.
Élongation
Le ribosome progresse alors de codon en codon au niveau de l'ARNm, en polymérisant un à un les acides aminés de la protéine. À chaque étape du cycle, les ARNt diffusent de manière stochastique dans le site A du ribosome. Lorsqu'un ARNt porteur de l'anticodon complémentaire du codon de l'ARNm se fixe au site, il y a appariement. On parle de phase d'accommodation de l'ARNt.
Les ARNt qui diffusent dans le site A (aminoacid) portent estérifié à leur extrémité 3'-OH l'acide aminé correspondant dans le code génétique à leur anticodon. Cette estérification a été réalisée au préalable par une aminoacyl-ARNt synthétase. On a ainsi correspondance entre le codon et l'acide aminé à incorporer dans la protéine, suivant le programme porté par l'ARNm.
Ces ARNt arrivent au ribosome complexés au facteur d'élongation EF-Tu (bactéries) ou eEF-1 (eucaryotes) lié au GTP. Lors de l'accomodation correcte, ce facteur d'élongation hydrolyse le GTP en GDP.
La grande sous-unité du ribosome catalyse ensuite la formation de la liaison amide entre la fonction carboxylique de l'acide aminé fixé à l'ARNt du site P (peptide) et l'amine de l'acide aminé de l'ARNt situé au site A. Ceci aboutit au transfert de la chaîne peptidique en cours de synthèse sur l'ARNt du site A.
L'étape suivante est la translocation du ribosome de trois nucléotides sur l'ARNm, une étape qui nécessite l'intervention d'un deuxième facteur d'élongation, EF-G (bactéries) ou eEF-2 (eucaryotes), et l'hydrolyse d'une seconde molécule de GTP. À l'issue de cette étape, l'ARNt déacylé glisse au site E (exit) et l'ARNt portant la chaîne peptidique, au site P. Après dissociation de l'ARNt du site E, on revient à l'étape initiale du cycle.

Le polypeptide synthétisé émerge progressivement de la grande sous-unité du ribosome, au travers d'un "tunnel de sortie" spécifique traversant celle-ci. La protéine se replie progressivement, au fur et à mesure de l'avancée du processus de traduction[11]. Dans le cas de protéines membranaires ou sécrétées (dans le réticulum endoplasmique ou à l'extérieur de la cellule), la chaîne protéique démarre avec une séquence spécifique appelée peptide signal. Lorsque le peptide signal émerge du ribosome, ceci déclenche la pause de ce dernier et son attachement à une machinerie spécifique à la membrane, le translocon, permettant la translocation directe de la protéine au travers de la membrane, de manière couplée à l'élongation de sa synthèse[12].
Terminaison
Quand le ribosome parvient au niveau d'un codon stop (il en existe trois dans le code génétique : UGA, UAG ou UAA, ne correspondant à aucun acide aminé), il y a action des facteurs de terminaison. Ces facteurs sont au nombre de deux chez les eucaryotes (eRF1 et eRF3) et au nombre de 3 chez les procaryotes (RF1, RF2, RF3). Les facteurs de classe I (eRF1 et RF1, RF2) reconnaissent directement les codons stop, alors que les facteurs de classe II ont une activité GTPase qui a pour but de stimuler le relargage des facteurs de classe I. On peut noter ici une différence majeure, qui est que le facteur eucaryote eRF1 reconnaît les trois codons stop, alors que chez les procaryotes RF1 reconnaît les codons UAG et UAA, et RF2 UGA, UAA. Ce dernier facteur est exprimé grâce à un événement de décalage du cadre de lecture qui sert de mécanisme d'autorégulation traductionnelle du facteur RF2. Chez les eucaryotes le mécanisme de dissociation et de recyclage du ribosome demeurent largement incompris alors qu'il est beaucoup mieux décrit chez les procaryotes. Chez ces derniers un quatrième facteur (le RRF) agit en combinaison avec les facteurs IF3 et EFG pour provoquer la dissociation complète des deux sous unités du ribosome. L'action de ces facteurs a pu être visualisée par cryo-EM.
Traduction multiple
Un ARNm peut être traduit par plusieurs ribosomes à la fois. L'ensemble formé par un ARNm et plusieurs ribosomes se déplaçant dessus s'appelle un polysome. Comme le phénomène de traduction a lieu plusieurs fois consécutivement à partir d'un même ARNm, il est donc fréquent de trouver des protéines identiques fabriquées à partir de celui-ci. La traduction est donc un processus d'amplification de l'expression des gènes à partir de l'ARNm produit par transcription.
Inhibiteurs - antibiotiques
Le processus de traduction peut être bloqué par un certain nombre de molécules, en particulier chez les bactéries. Ces composés ont alors une action antibiotique, car l'inhibition de la synthèse protéique bloque la croissance bactérienne[13]. Certains antibiotiques bloquent ou interfèrent avec le décodage du message sur l'ARN messager et agissent sur la petite sous-unité du ribosome (aminoglycosides, cyclines...). D'autres bloquent l'étape de synthèse de la liaison peptidique ou le tunnel de sortie du ribosome et agissent sur la grande sous-unité du ribosome (macrolides, lincosamides, synergistines). Certains agissent enfin sur les facteurs associés à la traduction et bloquent par exemple la translocation (acide fusidique...).
Certains de ces composés agissent aussi sur la traduction dans les cellules eucaryotes et ont alors une activité cytotoxique, comme la généticine.
Contrôle qualité
La traduction peut se retrouver bloquée ou altérée si l'ARNm est défectueux. Ceci se produit en particulier, soit lorsqu'il y a un codon stop prématuré, soit lorsqu'il n'y a pas de codon stop, ce qui aboutit à la production d'une protéine anormale, voir au blocage du ribosome. Il existe différents mécanismes de contrôle qualité, dits de surveillance de l'ARN messager, qui permettent l'élimination de la protéine anormale et/ou la dégradation de l'ARNm défectueux[14]. Ceux-ci sont couplés à la traduction elle-même et font intervenir le ribosome et des facteurs accessoires spécifiques de reconnaissance de la situation anormale.
Chez les bactéries existe ainsi le mécanisme de trans-traduction par l'ARNtm et chez les eucaryotes, on a le mécanisme de dégradation des ARNm non sens.
Voir aussi
Liens externes
- Animation du DNA learning center de Cold Spring Harbor
Notes et références
- Donald Voet et Judith G. Voet, Biochimie, de Boeck, , 1600 p. (ISBN 978-2-8041-4795-2), p. 1285
- Xavier Coumoul, Frédéric Dardel et Étienne Blanc, Mémo visuel de biochimie : l'essentiel en fiches, Paris, Dunod, , 226 p. (ISBN 978-2-10-074226-4), p. 150-154-143
- Dominique Fourmy, Henri Grosjean et Satoko Yoshizawa, « Le ribosome : l'usine à protéines », Pour la Science, no 313, (ISSN 0036-8733, lire en ligne)
- La synthèse des protéines par le ribosome, un chemin semé d’embûches. Kevin Macé, Emmanuel Giudice et Reynald Gillet. Med Sci (Paris) Volume 31, Number 3, Mars 2015.
- (en) John W. B. Hershey, Nahum Sonenberg et Michael B. Mathews, « Principles of Translational Control: An Overview », Cold Spring Harbor Perspectives in Biology, vol. 4, , a011528 (ISSN 1943-0264, PMID 23209153, PMCID 3504442, DOI 10.1101/cshperspect.a011528, lire en ligne, consulté le )
- Nahum Sonenberg et Alan G. Hinnebusch, « Regulation of Translation Initiation in Eukaryotes: Mechanisms and Biological Targets », Cell, vol. 136, , p. 731–745 (ISSN 0092-8674, PMID 19239892, PMCID 3610329, DOI 10.1016/j.cell.2009.01.042, lire en ligne, consulté le )
- J. Shine et L. Dalgarno, « The 3'-terminal sequence of Escherichia coli 16S ribosomal RNA: complementarity to nonsense triplets and ribosome binding sites », Proceedings of the National Academy of Sciences of the United States of America, vol. 71, , p. 1342–1346 (ISSN 0027-8424, PMID 4598299, PMCID 388224, lire en ligne, consulté le )
- S. Z. Tarun et A. B. Sachs, « Association of the yeast poly(A) tail binding protein with translation initiation factor eIF-4G », The EMBO journal, vol. 15, , p. 7168–7177 (ISSN 0261-4189, PMID 9003792, PMCID 452544, lire en ligne, consulté le )
- Nahum Sonenberg et Alan G. Hinnebusch, « Regulation of Translation Initiation in Eukaryotes: Mechanisms and Biological Targets », Cell, vol. 136, , p. 731–745 (PMID 19239892, PMCID 3610329, DOI 10.1016/j.cell.2009.01.042, lire en ligne)
- M. Kozak, « Possible role of flanking nucleotides in recognition of the AUG initiator codon by eukaryotic ribosomes », Nucleic Acids Research, vol. 9, , p. 5233–5252 (ISSN 0305-1048, PMID 7301588, PMCID 327517, lire en ligne, consulté le )
- Ola B. Nilsson, Rickard Hedman, Jacopo Marino et Stephan Wickles, « Cotranslational Protein Folding inside the Ribosome Exit Tunnel », Cell Reports, vol. 12, , p. 1533–1540 (ISSN 2211-1247, PMID 26321634, PMCID 4571824, DOI 10.1016/j.celrep.2015.07.065, lire en ligne, consulté le )
- Arthur E. Johnson et Michael A. van Waes, « The Translocon: A Dynamic Gateway at the ER Membrane », Annual Review of Cell and Developmental Biology, vol. 15, , p. 799–842 (ISSN 1081-0706, DOI 10.1146/annurev.cellbio.15.1.799, lire en ligne, consulté le )
- Carlo Cocito et Mario di Giambattista, « Les antibiotiques inhibiteurs de la synthèse protéique », Médecine/Sciences, no 6, , p. 46-54 (ISSN 0767-0974, lire en ligne).
- Milo B Fasken et Anita H Corbett, « Process or perish: quality control in mRNA biogenesis », Nature Structural & Molecular Biology, vol. 12, , p. 482–488 (DOI 10.1038/nsmb945, lire en ligne)
- Portail de la biologie cellulaire et moléculaire