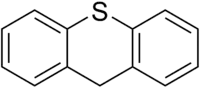
Thioxanthène
Le thioxanthène est l'équivalent soufré du xanthène, où un atome de soufre remplace l'atome d'oxygène.
| Thioxanthène | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.005.430 |
| No CE | 205-972-1 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C13H10S [Isomères] |
| Masse molaire[1] | 198,284 ± 0,016 g/mol C 78,75 %, H 5,08 %, S 16,17 %, |
| Propriétés physiques | |
| T° fusion | 128,55 °C[2] |
| T° ébullition | 341 °C[3] |
| Écotoxicologie | |
| LogP | 4,550[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Dérivé
Par extension, on appelle thioxanthènes les dérivés substitués du thioxanthène. Un certain nombre de thioxanthènes sont utilisés dans le traitement de la schizophrénie et des psychoses. L'activité de ces composés est liée à leur faculté d'inhiber les récepteurs D2 dans le cerveau.
On compte parmi les dérivés du thioxanthène:
- le chlorprothixène
- le flupentixol
- le thiothixène
- le zuclopenthixol
Les thioxanthènes sont une classe de molécules assez proches chimiquement des phénothiazines, la principale différence étant la présence d'un atome d'azote en position 10 (opposé à l'atome de soufre sur le cycle central).
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Coon, J.E.; Sediawan, W.B.; Auwaerter, J.E.; McLaughlin, E., Solubilities of families of heterocyclic polynuclear aromatics in organic solvents and their mixtures,J. Solution Chem., 1988, 17, 519. Incertitude de 0,1K d'après le Thermodynamics Research Center.
- (en) « Thioxanthène », sur ChemIDplus
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.