Théorie de Witt
La théorie de Witt permet d'expliquer pourquoi une molécule organique est colorée et peut ainsi servir de colorant.
En 1876, le chimiste allemand Otto Nicklaus Witt[1] propose que la coloration des molécules serait due à l'existence dans la molécule de groupements d'atomes appelés chromophores et ayant la capacité d'absorber certaines fréquences lumineuses incidentes. La présence d'autres groupements appelés auxochromes modifie la fréquence d'absorption.
Doubles liaisons conjuguées
L'ensemble des chromophores forment une séquence de doubles liaisons conjuguées, c'est-à-dire une alternance de simples et de doubles liaisons. Les électrons de la liaison π de chaque double liaison, plus fragile que la liaison σ se délocalisent, et forment un nuage électronique. Celui-ci entre en résonance au passage d'un rayonnement de fréquence particulière et l'absorbe. La fréquence de résonance est d'autant plus faible que le nombre d'électrons est important.
Chromophores principaux
Les chromophores possèdent une ou plusieurs doubles liaisons qui forment une séquence de doubles liaisons conjuguées avec le reste de la molécule.

Auxochromes principaux
Les auxochromes sont des groupements ionisables qui peuvent modifier la couleur du colorant.
- Auxochromes acides :
 .
. - Auxochromes basiques :
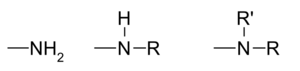 .
. - Atomes halogènes :
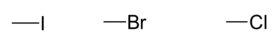 .
.
Notes et références
Voir aussi
Liens internes
Liens externes
- Portail de la chimie
- Portail des couleurs